Triossido di diazoto
| Triossido di diazoto | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| trioxido-1κ2O,2κO-dinitrogen(N—N) | |
| Nomi alternativi | |
| anidride nitrosa, ossido di azoto(III) sesquiossido di azoto (arcaico) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2O3 |
| Aspetto | solido o liquido blu |
| Numero CAS | |
| Numero EINECS | 234-128-5 |
| PubChem | 61526 |
| SMILES | N(=O)[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,447 |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | -100,7 °C (172,5 K) |
| Temperatura di ebollizione | ~ 3,5 °C (~ 276,6 K) (con dissociazione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
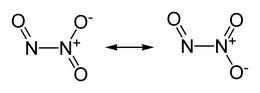
Il triossido di diazoto,[1] nome sistematico ossido di azoto(III) e noto come anidride nitrosa in nomenclatura tradizionale,[2] è un ossido dell'azoto di formula molecolare N2O3 in cui N è allo stato di ossidazione +3 (medio[3]). La sua formula semistrutturale è ON−N(O)2, dove un atomo di azoto è +2 e l'altro +4. Nonostante questa insolita struttura, formalmente è l'anidride dell'acido nitroso,[4] ma si mostra esserlo anche di fatto (vide infra). Questa forma molecolare vale nella condizione più stabile per questo composto, che si ha a basse temperature, sia allo stato solido che in parte allo stato liquido (punto di fusione -100,7 °C, punto di ebollizione ~ 3,5 °C), entrambi di colore azzurro.[5]
Già in parte allo stato liquido, infatti, ma specialmente allo stato di vapore si instaura un equilibrio di dissociazione in monossido di azoto e biossido di azoto e il grado di dissociazione aumenta all'aumentare della temperatura:
La dissociazione e quindi la formazione dei prodotti inizia ad essere apprezzabile a partire da circa -30 °C.[7]
Proprietà[modifica | modifica wikitesto]
Il triossido di diazoto è già scarsamente stabile di suo, essendo un composto piuttosto endotermico, ΔHƒ° = +84,82 kJ/mol [8] e l'altro suo possibile isomero molecolare (O=N−O−N=O, nitrito di nitrosile, la forma attesa per l'anidride nitrosa[2]) è ancora meno stabile (ΔHƒ°calcolato = +97,9 kJ/mol)[9] e di esso si conosce solo qualche dato spettrale.[10] Un terzo possibile isomero sarebbe quello ionico, nitrito di nitrosonio [NO+ NO2−] che è sconosciuto materialmente, ma calcoli teorici prevedono per esso un'entalpia di formazione standard parecchio più alta, almeno 113,8 kJ/mol.[9]
Il triossido di diazoto è solubile in tetracloruro di carbonio, cloroformio, benzene e toluene, dando in ogni caso soluzioni azzurre.[11]
Da indagini spettroscopiche rotazionali nella regione delle microonde su N2O3 si ricava che la molecola è planare con simmetria Cs[12] ed alquanto polare (μ = 2,12 D),[13] con il nitrosile NO parzialmente positivo e il gruppo nitro NO2 parzialmente negativo.[14]
Da indagini spettroscopiche infrarosse, effettuate in alta risoluzione con trasformata di Fourier sul vapore di N2O3 a 230 K (-43 °C), risulta, tra l'altro, che il legame N−N è insolitamente lungo, ben 186,4 pm, e quindi presumibilmente molto debole;[15] per confronto, il valor medio di tale legame ammonta a 147 pm.[16] e nell'idrazina (H2N−NH2) è ancora un po' più corto (145 pm).[17] In questo contesto è bene comunque notare che anche il legame N−N nel tetrossido di diazoto (O2N−NO2), che è soggetto a dissociazione, è anch'esso molto lungo: 178,2 pm.[18]
Sintesi e reattività[modifica | modifica wikitesto]
La maniera più semplice di ottenere il triossido di diazoto consiste nel far condensare a bassa temperatura (< -20 °C) il monossido di azoto e il biossido di azoto:[19]
NO + NO2 ⇄ N2O3
oppure ancora il monossido di azoto e l'ossigeno in quantità stechiometrica.[14] Si ottiene in tal modo un liquido azzurro intenso che quando viene gradatamente riscaldato diviene di colore verdastro, perché in tal modo cresce la quantità formata di NO2, che è arancione.[6]
Un'altra via consiste nel far reagire a bassa temperatura il tetrossido di diazoto liquido con carbonato di litio, in presenza di tracce di umidità:[20]
Li2CO3 (s) + N2O4 (liq) → 2 LiNO3 + N2O3 + CO2
La reattività di N2O3 in condizioni ordinarie è spesso approssimabile a quella di una miscela equimolecolare di monossido di azoto NO e diossido di azoto NO2. Nonostante che la struttura della molecola non sia quella normale per un'anidride inorganica e nonostante la dissociazione, la reazione di N2O3 con soluzioni acquose fornisce soluzioni di acido nitroso:[19]
N2O3 + H2O → 2 HNO2
Questo, essendo un acido debole, nella soluzione è parzialmente dissociato in ione idrossonio e ione nitrito:
HNO2 + H2O ⇄ H3O+ + NO2− [ pKa = 3,29 ][21]
Questa trasformazione del triossido di diazoto in acqua è molto più rapida e completa se la soluzione è alcalina e in tal caso si ottengono i corrispondenti nitriti.[22]
Il triossido di diazoto reagisce con acidi molto forti, come l'acido perclorico o tetrafluoroborico, per generare i corrispondenti sali di nitrosonio:[23][24]
N2O3 + 3 HClO4 → 2 [N≡O]+ [ClO4]− + [H3O]+ [ClO4]−
N2O3 + 2 HBF4 → 2 [N≡O]+ [BF4]− + H2O
Note[modifica | modifica wikitesto]
- ^ dinitrogen trioxide (CHEBI:29799), su ebi.ac.uk. URL consultato il 16 febbraio 2024.
- ^ a b (EN) Dario A. Vitturi, Lucia Minarrieta e Sonia R. Salvatore, Convergence of biological nitration and nitrosation via symmetrical nitrous anhydride, in Nature Chemical Biology, vol. 11, n. 7, 2015-07, pp. 504–510, DOI:10.1038/nchembio.1814. URL consultato il 16 febbraio 2024.
- ^ Al quale numero di ossidazione fa riferimento il nome sistematico.
- ^ (DE) Ralf Steudel, Chemie der Nichtmetalle, 4ª ed., Walter de Gruyter GmbH, 2014, p. 366, DOI:10.1515/9783110307979.
- ^ Norman Neill Greenwood e Alan Earnshaw, 11 - Nitrogen, in Chemistry of the elements, 2nd ed, Butterworth-Heinemann, 1997, p. 444, ISBN 978-0-7506-3365-9.
- ^ a b Norman Neill Greenwood e Alan Earnshaw, 11 - Nitrogen, in Chemistry of the elements, 2nd ed, Butterworth-Heinemann, 1997, p. 454, ISBN 978-0-7506-3365-9.
- ^ Michael Binnewies, Maik Finze e Manfred Jäckel, Allgemeine und anorganische Chemie, collana Lehrbuch, 3., vollständig überarbeitete Auflage, Springer Spektrum, 2016, p. 566, DOI:10.1007/978-3-662-45067-3, ISBN 978-3-662-45066-6. URL consultato il 15 febbraio 2024.
- ^ M. W. Chase, NIST-JANAF Themochemical Tables, Fourth Edition, 1998, pp. 1–1951. URL consultato il 15 febbraio 2024.
- ^ a b (EN) I. I. Zakharov e O. I. Zakharova, Nitrosonium nitrite isomer of N2O3: Quantum-chemical data, in Journal of Structural Chemistry, vol. 50, n. 2, 1º aprile 2009, pp. 212–218, DOI:10.1007/s10947-009-0031-1. URL consultato il 15 febbraio 2024.
- ^ Experimental data for ONONO (Nitrosyl nitrite), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ P. W. Schenk, Handbook of Preparative Inorganic Chemistry, a cura di Georg Brauer, vol. 1, 1963, p. 488, DOI:10.1016/b978-0-12-395590-6.x5001-7. URL consultato il 15 febbraio 2024.
- ^ Experimental data for N2O3 (Dinitrogen trioxide), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ (EN) K.-H. Hellwege, A. M. Hellwege (a cura di), Molecular Constants from Microwave, Molecular Beam, and Electron Spin Resonance Spectroscopy, in Landolt-Börnstein - Group II Molecules and Radicals, 1974, DOI:10.1007/b19951. URL consultato il 15 febbraio 2024.
- ^ a b F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, p. 328, ISBN 0-471-19957-5.
- ^ (EN) Leslie A. Chewter, Ian W.M. Smith e Gregory Yarwood, A high resolution FTIR spectroscopic study of the nv 1 ( n = 1–4) bands of N 2 O 3, in Molecular Physics, vol. 63, n. 5, 10 aprile 1988, pp. 843–864, DOI:10.1080/00268978800100601. URL consultato il 15 febbraio 2024.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ Experimental data for N2H4 (Hydrazine), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ Bruce W. McClelland, Grete Gundersen e Kenneth Hedberg, Reinvestigation of the Structure of Dinitrogen Tetroxide, N2O4, by Gaseous Electron Diffraction, in The Journal of Chemical Physics, vol. 56, n. 9, 1º maggio 1972, pp. 4541–4545, DOI:10.1063/1.1677901. URL consultato il 15 febbraio 2024.
- ^ a b Therald Moeller, Chemistry with Inorganic Qualitative Analysis, ACADEMIC PRESS, INC., 1980, p. 666, ISBN 978-0-12-503350-3, LCCN 79-89282.
- ^ Rajni Garg e Randhir Singh, 6. Non-aqueous Solvents, in Inorganic Chemistry, McGraw Hill Education, 2015.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 825, ISBN 978-3-11-026932-1.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103. Auflage, De Gruyter, 2017, pp. 810-811, ISBN 978-3-11-026932-1.
- ^ James E. House e James Evan House, Inorganic chemistry, Elsevier Academic Press, 2008, p. 491, ISBN 978-0-12-356786-4.
- ^ P. W. Schenk, Handbook of Preparative Inorganic Chemistry, a cura di Georg Brauer, vol. 1, 1963, p. 224, DOI:10.1016/b978-0-12-395590-6.x5001-7. URL consultato il 15 febbraio 2024.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su triossido di diazoto
Wikimedia Commons contiene immagini o altri file su triossido di diazoto
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) dinitrogen trioxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
