Diazene
| Diazene | |
|---|---|
 | |
| Nome IUPAC | |
| Diazene[1] | |
| Nomi alternativi | |
| Diimmide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H2N2 |
| Massa molecolare (u) | 30.02936[2] |
| Numero CAS | Immagine_3D_isodiazina |
| PubChem | 123195 |
| SMILES | N=N |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | ---[3] |
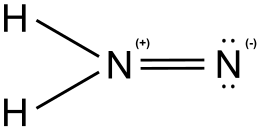
Il diazene, anche detto diimmide o diimina nel caso di composti organici, è un composto inorganico dell'azoto con l'idrogeno con formula chimica N2H2 con un legame doppio N=N, a differenza dell'idrazina con un legame semplice N-N. Il termine diazene è più usato per derivati organici del termine diimmide. Quindi, azobenzene (C6H5-N=N-C6H5) è un esempio di diazene organico.
Il diazene forma la struttura di base dei composti organici detti azoici. È instabile a temperatura ambiente. Il diazene metastabile puro, solido, al di sotto di -180 °C ha un colore giallo brillante. Il composto non è sublimabile, è molto sensibile alla luce e si decompone con sproporzione in azoto e idrazina.
Struttura[modifica | modifica wikitesto]
Esiste in due isomeri geometrici, E (trans) e Z (cis) e un isomero strutturale detto iso.
Struttura del composto E(trans)-diazene
|
Struttura del composto Z(cis)-diazene
|
Struttura del composto iso-diazene
|
Sintesi e rivelazione[modifica | modifica wikitesto]
Il metodo standard per produrre diazene è l'ossidazione dell'idrazina con il perossido di idrogeno (H2O2) o con aria.[4]
Un altro metodo è la decarbossilazione dell'acido azodicarbossilico (HOOC-N=N-COOH) secondo la reazione chimica:[5]
Oppure per eliminazione di sulfonoidrazide (un gruppo di composti organici con struttura R-SO2-NH-NH2) usando una base di Lewis adatta. Ad esempio, utilizzando l'idrazide 2,4,6-triisopropilbenzenesulfonoidrazide:
e trattandola con la base bicarbonato di sodio (NaHCO3) si elimina il diazene.
Essendo un composto instabile, il diazene viene generato e usato in-situ. Viene prodotta una miscela sia di isomeri cis (Z-) sia trans (E-). Questi sono instabili, e subiscono una lenta interconversione. L'isomero trans è più stabile, ma l'isomero cis è quello che reagisce con substrati insaturi, quindi l'equilibrio va in direzione dell'isomero cis per il principio di Le Châtelier. Alcune procedure richiedono l'aggiunta di acido carbossilico, che catalizzano l'isomerizzazione cis-trans.[6] Il diazene si decompone subito. Inoltre a basse temperature (ca. -130 °C), l'isomero più stabile trans subisce rapidamente varie reazioni di disproporzione, formando primariamente idrazina e gas di azoto:[5]
A causa di questa reazione di decomposizione a competere, le riduzioni con diazene solitamente richiedono una forte quantità del reagente precursore.
Rivelazione[modifica | modifica wikitesto]
La sostanza fu isolata per la prima volta nel 1972 da Nils Wiberg e collaboratori. In questo caso, una termolisi del composto sodio tosilidrazide (un composto organico del genere sulfonoidrazide) è stata effettuata sotto vuoto a 60 °C. La tosilidrazide fu decomposta con resa dell'80% in diazene e toluensolfato di sodio (formula Na(SO2C6H4CH3) ). Il diazene è stato depositato come un rivestimento giallo brillante a -196 °C su uno strumento di laboratorio detto dito-freddo. La rilevazione nel gas era la spettrometria di massa. La preparazione è anche riuscita con altre tosilidrazidi di metalli alcalini, ma con una resa inferiore.[7]
Il diazene si può rivelare tramite reazioni chimiche come la stereospecifica, quella molto selettiva della cis-idrogenazione dei legami C=C tramite idrazina e un ossidante, inoltre si può rivelare tramite spettrometria di massa nella decomposizione in fase gassosa sia di ammoniaca (NH3) sia di idrazina (N2H4) su superficie di rodio.[8]
Applicazioni[modifica | modifica wikitesto]
Sintesi organica[modifica | modifica wikitesto]
Il diazene a volte è utile come reagente in sintesi organica.[6]
Questo idrogenica alcheni e alchini con selettivo rilascio di idrogeno da una parte del substrato dovuta alla stereoselettivita come aggiunta di H2 catalizzata dal metallo syn. L'unico coprodotto rilasciato è gas di azoto (N2). Sebbene sia un sistema che richiede diversi strumenti di laboratorio, l'utilizzo del diazene annulla la necessità di pressioni alte quando si usa il gas idrogeno e un catalizzatore metallico, che sono metodi costosi.[9]
Il meccanismo di idrogenazione implica uno stato di transizione con sei membri (C2H2N2):
Riduzione selettiva[modifica | modifica wikitesto]
Il diazene offre il vantaggio di riduzione selettiva di alcheni e alchini e non reagisce verso molti gruppi funzionali che possono influenzare il processo di idrogenazione catalitica. Quindi, perossidi, alogenuri alchilici, e tioli sono tollerati dalil diazene, ma possono essere di solito degradati dai catalizzatori metallici. Il reagente tende a ridurre alchini e alcheni senza ostacoli o vincoli[4] al corrispondente alchene e alcano.[6]
Composti derivati[modifica | modifica wikitesto]
Inorganici[modifica | modifica wikitesto]
- Un derivato del diazene è l'acido iponitroso detto pure diazendiolo (HO-N=N-OH).
- Il composto gassoso difluoro diazoto o difluorodiazene (N2F2). Ha la struttura F−N=N−F e ha isomeri geometrici.
Organici[modifica | modifica wikitesto]
- Gli azocomposti acidi come l'acido azodicarbossilico o diazendicarbossilico ( HOOC-N=N-COOH oppure N2(COOH)2 ) o le loro ammidi ed esteri stabili, ad esempio dietil azodicarbossilato (H5C2-OOC-N=N-COO-C2H5 oppure C6H10N2O4).
- Sono noti anche gli azosilani, come la trans-bis (trimetilsilil) diimmina ( (CH3)3Si-N=N-Si(CH3)3 ).
Ioni correlati[modifica | modifica wikitesto]
Il diazene possiede una certa tendenza a protonarsi; a seconda dei casi può subire una protonazione singola o doppia con la formazione rispettivamente del catione diazenio e del diazenio dicatione.
diazenio[modifica | modifica wikitesto]
Lo ione diazenio ha formula chimica N2H+3 con le strutture:
presenta una carica positiva dislocata sull'atomo di azoto derivato dalla protonazione del diazene
diazenio dicatione[modifica | modifica wikitesto]
Lo ione diazenio dicatione ha formula chimica N2H2+4 con le strutture:
presenta due cariche positive nette dislocate sugli atomi di azoto, cariche che derivano dalla doppia protonazione del diazene
Confrontandoli con lo diazonio dicatione, HNNH2+, questi ammette il più forte legame chimico conosciuto. Questo ione proviene da una doppia protonazione della molecola di azoto. L'ordine della forza legame relativa (RBSO) è di 3,38.[10]
Gli unici ioni conosciuti, i dicationi diazoidrofluoronio e diazofluoronio FNNH2+ e FNNF2+, ammettono una forza di legame leggermente minore.[10]
Note[modifica | modifica wikitesto]
- ^ (EN) Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). 6ed, Cambridge (UK), RSC/IUPAC (2005). ISBN 0-85404-438-8. Versione elettronica.
- ^ (EN) IUPAC, Atomic weights of the elements 2017, su Queen Mary University of London.
- ^ gestis-en.itrust.de, https://web.archive.org/web/20191016183546/http://gestis-en.itrust.de/ (archiviato dall'url originale il 16 ottobre 2019).
- ^ a b (EN) cis-Cyclododecene, in Org. Synth., vol. 49, 1969, pp. 30, DOI:10.15227/orgsyn.049.0030. Vol. Coll., vol. 5, 1973, pp. 281.
- ^ a b (EN) Wiberg, E. e Holleman, A.F., 1.2.7: Diimine, N2H2, in Inorganic Chemistry, Elsevier, 2001, p. 628, ISBN 978-01-23-52651-9.
- ^ a b c (EN) D.J. Pasto, Diimide, Encyclopedia of Reagents for Organic Synthesis, Hoboken (New Jersey,USA), John Wiley & Sons, 2001, DOI:10.1002/047084289X.rd235.
- ^ (DE) Nils Wiberg, Heinz Bachhuber e Gerd Fischer, Isolierung von Diimin, in Angew. Chem. Int. Ed., vol. 84, n. 18, 1972, pp. 889-890, DOI:10.1002/ange.19720841808.
- ^ (EN) J. Prasad e J.L. Gland, Diimide formation on rhodium surfaces: a temperature-programmed reaction spectroscopy study, in J. Am. Chem. Soc., vol. 113, n. 5, 1991, pp. 1577-1579, DOI:10.1021/ja00005a020.
- ^ (EN) Miller, C.E., Hydrogenation with Diimide, in J. Chem. Educ, vol. 42, n. 5, 1965, pp. 254-259, DOI:10.1021/ed042p254.
- ^ a b (EN) Kalescky Robert, Kraka Elfi e Cremer Dieter, Identification of the Strongest Bonds in Chemistry, in J. Phys. Chem. A, vol. 117, n. 36, 2013, pp. 8981-8995, DOI:10.1021/jp406200w.
Bibliografia[modifica | modifica wikitesto]
- (EN) Frank A. Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., New York, Wiley-Interscience, 1999, ISBN 0-471-19957-5.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su diazene
Wikimedia Commons contiene immagini o altri file su diazene

















