Triazene
| Triazene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Triazene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H3N3 |
| Massa molecolare (u) | 45.05 gm mole-1 |
| Aspetto | colorato con odore forte e sgradevole |
| Numero CAS | |
| PubChem | 115034 |
| SMILES | NN=N |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |

Il triazene è un composto inorganico insaturo con formula chimica N3H3. Ha un legame doppio covalente ed appartiene alla classe dei composti detti azeni. Non si trova allo stato naturale.
Triazeni è anche il nome generico dei derivati del triazene, caratterizzati da un gruppo funzionale, chiamato triazene o gruppo azoammino, costituito da un'ammina legata direttamente ad un gruppo funzionale azo (-N=N-), con R1R2N-N=NR3 dove R1, R2 ed R3 sono i sostituenti. Nei triazeni la nomenclatura sistematica utilizza il prefisso diazoammino , che viene aggiunto al nome del composto genitore sostituente in R3: per esempio, Ph-N=N-NHMe viene chiamato N-metil diazoammino benzene.
Proprietà[modifica | modifica wikitesto]
A temperatura ambiente, il triazene è allo stato gassoso e, come tanti altri azeni, è colorato con un odore forte e sgradevole. Ha un punto di ebollizione e una densità maggiori del diazene dovuto alla massa maggiore. Ha punto ebollizione leggermente minore del composto triazano e quindi è più volatile. Ha un legame polare forte, e la molecola ha un grande momento di dipolo per la sua ridotta simmetria.
Il triazene è un gruppo funzionale ricco di elettroni e capace di assorbire cationi metallici[1] e organici.[2]
Nei triazeni N1,N3-disostituiti con gruppi diversi si hanno due possibili tautomeri:

Medicina[modifica | modifica wikitesto]
Alcuni medicinali anti-tumorali sono denominati triazenici perché contengono un gruppo funzionale triazene. I triazenici sono un gruppo di agenti alchelanti utilizzati per combattere le cellule tumorali.[3]
Esempi sono la dacarbazina e la temozolomide. Lavorano da guanina metilante nelle posizioni O-6 e N-7.
Produzione e composti[modifica | modifica wikitesto]
Il triazene può essere ottenuto da idrazina da radiolisi a impulsi .[4]
Tuttavia, il composto è instabile e si decompone in ammoniaca e azoto L'emivita di decomposizione a temperatura ambiente in acqua a pH acido è di 1/100 s , a pH debolmente alcalino è 100 s.[5]
Ad oggi, l'unico metodo comprovato per produrre triazene è la decomposizione spontanea del tetrazene in triazene e ammoniaca.
1,3-Difeniltriazene[modifica | modifica wikitesto]
Un noto derivato del triazene è il seguente:[6]

- Ph-NH-N=N-Ph (m.p. 100 °C, CAS #136-35-6).
L'1,3-difeniltriazene viene preparato dalla reazione di un sale benzendiazonio con l'anilina in ambiente basico (Carbonato di sodio o Acetato di sodio).[7]
- Ph-N2+ + Ph-NH2 → Ph-N=N-NH-Ph + H+
Bis-triazene[modifica | modifica wikitesto]
Un esempio di composto del triazene derivato dalla base di Torger.
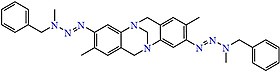
Una base di Torger ha formula chimica (CH3C6H4NCH2)2CH2, il composto viene ottenuto dalla reazione N-accoppiamento tra un sale di bis-diazonio e un'ammina secondaria (N-Metilanilina).[8]
Polimeri[modifica | modifica wikitesto]
Composti del triazene polimerici sono prodotti e applicati come materiali conduttivi e absorbenti.[2]
Reazioni[modifica | modifica wikitesto]
I triazenici sono usati come sorgente in situ dello ione diazonio.[7] I triazenici si decompongono o per protonamento o per agente alchilante in Ammina quaternaria e sale di diazonio.[7] Un modo per la protezione o non-protezione di ammine secondarie sensibili si basa su questo principio..[9]
I triazenici possono reagire con Solfuro di sodio in presenza di Acido tricloroacetico per formare il corrispondente tiofenolo.[8][10]

Conversione triazene a tiofenolo
Il gruppo triazene può convertirsi in lattami funzionalizzati,[11] triazoli, dibenzopiranoni, e cumarina, o come substrato per perfluoroalchilazione[8] e reazioni di diazinilazione.[12][13]
In un altro esempio, la sintesi di cinnolina è stata ottenuta con la Reazione di Richter dello ione diazonio mascherato con triazene.
Note[modifica | modifica wikitesto]
- ^ Mohammad k Rofouei, Reza Soleymani, Abolfazl Aghaei e Mahmoud Mirzaei, Synthesis, vibrational, electrostatic potential and NMR studies of (E and Z) 1-(4-chloro-3-nitrophenyl)-3-(2-methoxyphenyl)triazene: Combined experimental and DFT approaches, in Journal of Molecular Structure, vol. 1125, pp. 247–259, Bibcode:2016JMoSt1125..247R, DOI:10.1016/j.molstruc.2016.06.053.
- ^ a b Ardeshir Khazaei, Masoud Kazem-Rostami, Abdolkarim Zare, Ahmad Reza Moosavi-Zare, Mahdieh Sadeghpour e Abbas Afkhami, Synthesis, characterization, and application of a triazene-based polysulfone as a dye adsorbent, in Journal of Applied Polymer Science, vol. 129, n. 6, 15 settembre 2013, pp. 3439–3446, DOI:10.1002/app.39069/abstract, ISSN 1097-4628.
- ^ Jure Vajs, Ivana Steiner, Anamaria Brozovic, Andrej Pevec, Andreja Ambriović-Ristov, Marija Matković, Ivo Piantanida, Damijana Urankar e Maja Osmak, The 1,3-diaryltriazenido(p-cymene)ruthenium(II) complexes with a high in vitro anticancer activity, in Journal of Inorganic Biochemistry, vol. 153, pp. 42–48, DOI:10.1016/j.jinorgbio.2015.09.005.
- ^ Reinhard Haubold, Peter Merlet e Ulrike Ohms-Bredeman, N Nitrogen : Supplement Volume B2 Compounds with Noble Gases and Hydrogen, Achte, völlig neu bearbeitete Auflage, Springer Berlin Heidelberg, 1993, ISBN 978-3-662-06336-1, OCLC 851373121. URL consultato il 17 maggio 2021.
- ^ Arnold F. Holleman e Nils Wiberg, Anorganische ChemienBand 1, Grundlagen und Hauptgruppenelemente, vol. 1, 103. Auflage, 2017, ISBN 978-3-11-026932-1, OCLC 968134975. URL consultato il 17 maggio 2021.
- ^ Hartman, W. W. e Dickey, J. B., Diazoaminobenzene, Organic Syntheses, 1934.
- ^ a b c Masoud Kazem-Rostami, Ardeshir Khazaei, Ahmad Moosavi-Zare, Mohammad Bayat e Shahnaz Saednia, Novel One-Pot Synthesis of Thiophenols from Related Triazenes under Mild Conditions, in Synlett, vol. 23, n. 13, agosto 2012, pp. 1893–1896, DOI:10.1055/s-0032-1316557, ISSN 0936-5214. URL consultato il 5 agosto 2019 (archiviato dall'url originale il 3 giugno 2018).
- ^ a b c Masoud Kazem-Rostami, Facile Preparation of Λ-Shaped Building Blocks: Hünlich Base Derivatization, in Synlett, vol. 28, n. 13, agosto 2017, pp. 1641–1645, DOI:10.1055/s-0036-1588180, ISSN 0936-5214. URL consultato il 5 agosto 2019 (archiviato dall'url originale il 7 giugno 2018).
- ^ Lazny, R., Poplawski, J., Köbberling, J., Enders, D. e Bräse, S., Triazenes: A Useful Protecting Strategy for Sensitive Secondary Amines, in Synlett, vol. 1999, n. 8, 1999, pp. 1304–6, DOI:10.1055/s-1999-2803.
- ^ M. Kazem-Rostami, A. Khazaei, A. R. Moosavi-Zare, M. Bayat e S. Saednia, Novel One-Pot Synthesis of Thiophenols from Related Triazenes under Mild Conditions, in Synlett, vol. 23, n. 13, 2012, pp. 1893–6, DOI:10.1055/s-0032-1316557.
- ^ Martina Petrović, Dina Scarpi, Martin Nieger, Nicole Jung, Ernesto G. Occhiato e Stefan Bräse, Oxidation of diazenyl-protected N-heterocycles – a new entry to functionalized lactams, in RSC Adv., vol. 7, n. 16, 30 gennaio 2017, pp. 9461–9464, DOI:10.1039/c6ra26546d, ISSN 2046-2069.
- ^ Yonghong Zhang, Haiyan Hu, Chen-Jiang Liu, Dawei Cao, Bin Wang, Yadong Sun e Ablimit Abdukader, Highly Efficient Brønsted Acidic Ionic Liquid Promoted Direct Diazenylation of Pyrazolones with Aryltriazenes under Mild Conditions, in Asian Journal of Organic Chemistry, vol. 6, n. 1, 1º gennaio 2017, pp. 102–107, DOI:10.1002/ajoc.201600475/abstract, ISSN 2193-5815.
- ^ Dawei Cao, Yonghong Zhang, Chenjiang Liu, Bin Wang, Yadong Sun, Ablimit Abdukadera, Haiyan Hu e Qiang Liu, Ionic Liquid Promoted Diazenylation of N-Heterocyclic Compounds with Aryltriazenes under Mild Conditions, in Organic Letters, vol. 18, n. 9, 6 maggio 2016, pp. 2000–2003, DOI:10.1021/acs.orglett.6b00605, ISSN 1523-7060.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Triazene
Wikimedia Commons contiene immagini o altri file su Triazene

