Utente:Grasso Luigi/sanbox1/sale di diazonio

I sali di diazonio sono composti ionici organici caratterizzati dal gruppo funzionale -N≡N+. Sintetizzati per la prima volta nel 1858 a partire da ammine aromatiche, i sali di diazonio ricoprirono presto un ruolo importante nella produzione industriale dei coloranti azoici[1].
Tendenzialmente esistono in forma salificata con gli alogenuri (da qui la dicitura "sali di diazono", di formula generale R-N≡N+X−, dove R può essere un radicale alchilico o arilico)[2].
Preparazione[modifica | modifica wikitesto]
Il processo di formazione dei composti del diazonio è chiamato diazotazione, "diazoniazione" o "diazonizzazione". La reazione è stata per prima riferita da Peter Griess nel 1858, che successivamente scoprì diverse reazioni di questa nuova classe di composti. Comunemente, i sali di diazonio sono prodotte trattando ammine aromatiche con acido nitroso e altri acidi. Di solito l'acido nitroso è prodotto in situ (nello stesso flacone) da nitrito di sodio and da eccesso di acido inorganico (solitamente una soluzione acquosa di HCl,H2SO4, o HBF4):
- ArNH2 + HNO2 + H+ → ArN2+ + 2H2O

Soluzioni acquose di sali di cloruro di diazonio, tradizionalmente preparati dall'anilina, dal nitrito di sodio e dall'acido cloridrico, sono instabili sopra 5 °C. Tuttavia, si possono isolare i composti di diazoto come sali di tetrafluoroborato o di tosilato,[3] che sono solidi stabili a temperatura ambiente.
Spesso si preferisce che il sale di diazonio rimanga in soluzione, ma tende a supersaturare. Gli operatori sono stati feriti e qualcuno è morto per una inaspettata cristallizzazione del sale seguita dalla sua detonazione.[4]
A causa di questi rischi, i composti del diazonio di solito non sono isolati. Invece sono utilizzati in situ. Questo metodo viene mostrato nella preparazione di un composto arilsulfonile nell'immagine a sinistra.[5]
Reazioni di accoppiamento[modifica | modifica wikitesto]
La reazione più diffusa dei sali di diazonio è l'azocopulazione. In questo processo, il composto di diazonio è attaccato da substrati ricchi di elettroni, cioè accoppiati a elettroni. Quando i partner di accoppiamento sono areni come aniline e fenoli, il processo è un esempio di sostituzione elettrofila aromatica:
- ArN+2 + Ar′H → ArN2Ar′ + H+
Un'altra classe di composti commerciali per accoppiamento sono le ammidi acetoacetiche, come mostrato nella preparazione del Pigmento Giallo 12, un pigmento diarilidico.[6]
Gli azocomposti risultanti sono spesso coloranti utili e infatti sono chiamati azocoloranti.[7] I colori profondi delle tinture riflette la loro estesa coniugazione. Ad esempio, il colorante giallo anilina viene prodotto dalla miscela di anilina e soluzione fredda di sale di diazonio e scuotendoli vigorosamente. Il giallo anilina si ottiene come un giallo solido.[8]
Allo stesso modo, una soluzione di base fredda di Naphthalen-2-ol (Β-naftolo) produce un precipitato intensamente rosso-arancio. [8] Il metilarancio è un esempio di azocolorante che viene usato in laboratorio come indicatore pH.
Reazioni di spostamento del gruppo N2[modifica | modifica wikitesto]
Il gruppo diazo (N2) può essere sostituito in un processo detto dediazotazione, oppure "dediazonizzazione", che libera azoto (N2) e un carbocatione arilico o più comunemente in combinazione con il trasferimento a singolo elettrone e un radicale arilico.[9]
La dediazotazione è comunemente indotta dagli alogenuri. I cationi arildiazonici subiscono diverse reazioni in cui il gruppo N 2 viene sostituito da un altro gruppo o ione. Il processo è una reazione di sostituzione nucleofila aromatica che costituisce la base delle reazioni analizzate nel seguito.[10] [11]
Sostituzione con alogeni[modifica | modifica wikitesto]
Reazione di Sandmeyer[modifica | modifica wikitesto]
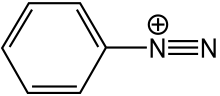
I sali di arildiazonio possono essere utilizzati come reagenti nelle sostituzioni nucleofile aromatiche tramite le reazioni di Sandmeyer.
Cloruro di benzenediazonio riscaldato con cloruro rameoso o bromuro rameoso dissolti il primo in HCl e il secondo in HBr producono rispettivamente clorobenzene o bromobenzene. La reazione chimica è la seguente:
- C6H5N+2 + CuCl → C6H5Cl + N2 + Cu+
Reazione di Gatterman[modifica | modifica wikitesto]
Nella reazione Gatterman, il cloruro di benzendiazonio viene riscaldato con polvere di rame e HCl o HBr per produrre clorobenzene e bromobenzene rispettivamente. Tale metodo prende il nome dal chimico tedesco Ludwig Gattermann.[12]
- C6H5N+2 + CuX → C6H5X + N2 + Cu+
Sostituzione con ioduro[modifica | modifica wikitesto]
Lo iodio non è facile da introdurre direttamente nell'anello benzenico. Tuttavia può essere introdotto trattando i cationi di arildiazonio con ioduro di potassio:
- C6H5N+2 + KI → C6H5I + K+ + N2
Sostituzione con fluoruro[modifica | modifica wikitesto]
Il fluorobenzene viene prodotto per decomposizione termica di fluoroborato di benzendiazonio. La conversione viene detta reazione di Balz-Schiemann.[13]
- [C6H5N+2]BF−4 → C6H5F + BF3 + N2
Sostituzioni con elementi misti[modifica | modifica wikitesto]
Sostituzione con idrogeno[modifica | modifica wikitesto]
I cationi arildiazonio sono ridotti da acido ipofosforoso o stannito di sodio (Na2SnO2) dando il benzene:
- [C6H5N+2]Cl− + H3PO2 + H2O → C6H6 + N2 + H3PO3 + HCl
Sostituzione con gruppo idrossile[modifica | modifica wikitesto]
I fenoli sono prodotti riscaldando una soluzione acquosa di sali di arildiazonio a 100 °C.
- C6H5N+2 + H2O → C6H5OH + N2 + H+
Questa reazione viene detta in tedesco Phenolverkochung ("cucinare fino a produrre fenoli"). Il fenolo formato può reagire con il sale di diazonio e quindi la reazione viene condotta in presenza di un acido che aiuta a sopprimere tale ulteriore reazione.
Sostituzione con gruppo nitro[modifica | modifica wikitesto]
Il nitrobenzene può essere ottenuto trattando il benzendiazonio fluoroborato con nitrito di sodio in presenza di rame. Oppure, la diazotizzazione dell'anilina può essere condotta in presenza di ossido rameoso, che genera nitrito rameoso in situ:
- C6H5N+2 + CuNO2 → C6H5NO2 + N2 + Cu+
Sostituzione con gruppo ciano[modifica | modifica wikitesto]
Il gruppo ciano solitamente non può introdursi per sostituzione nucleofilica di aloareni, ma tali composti possono essere preparati dai sali di diazonio. Un esempio è la preparazione di benzonitrile usando come reagente il cianuro rameoso:
- C6H5N+2 + CuCN → C6H5CN + Cu+ + N2
Questa reazione è un caso particolare della reazione di Sandmeyer.
Sostituzione con gruppo tiolo[modifica | modifica wikitesto]
I sali di diazonio possono convertirsi in tioli con una procedura a due-step. Trattando cloruro di benzendiazonio con etilxantato di potassio (abbreviato KEX-Potassium Ethyl Xanthate) seguito da idrolisi dall'estere xantato intermedio genera il tiofenolo:
- C6H5N+2 + C2H5OCS−2 → C6H5SC(S)OC2H5
- C6H5SC(S)OC2H5 + H2O → C6H5SH + HOC(S)OC2H5
Sostituzione con gruppo arile[modifica | modifica wikitesto]
Il gruppo arilico può essere accoppiato a un altro utilizzando i sali di arildiazonio. Ad esempio, trattando il cloruro di benzendiazonio con il benzene (composto aromatico) in presenza di idrossido di sodio genera bifenile:
- [C6H5N+2]Cl− + C6H6 → C6H5−C6H5 + N2 + HCl
Questa reazione prende il nome di reazione di Gomberg–Bachmann. Una conversione simile si ottiene anche trattando il cloruro di benzenediazonio con etanolo e polvere di rame.
Sostituzione con gruppo carbossile[modifica | modifica wikitesto]
I fluoroborati di diazonio reagiscono con un acido carbossilico alifatico producendo il corrispondente acido benzoico. Questa reazione provvede un metodo per preparare acidi carbossilici aromatici da acidi carbossilici alifatici:
- [C6H5N+2]BF−4 + RCO2H → C6H5CO2H + BF3 + N2 + RF
Reazione di Meerwein[modifica | modifica wikitesto]
Il cloruro di benzendiazonio reagisce con composti contenenti legami doppi attivati per fornire prodotti fenilati. La reazione viene detta arilazione di Meerwein:
- [C6H5N+2]Cl− + ArCH=CHCO2H → ArC=C−C6H5 + N2 + CO2 + HCl
Complessi metallici[modifica | modifica wikitesto]
Nelle reazioni con complessi metallici, i cationi diazonio si comportano come il catione nitrosonio NO+. Per esempio, complessi metallici a bassa valenza si aggiungono con sali di diazonio.
Complessi tipici sono: [Fe(CO)2(PPh3)2(N2Ph)]+ e il complesso chirale-a-metallo Fe(CO)(NO)(PPh3)(N2Ph).[14]
Altri metodi di dediazotazione[modifica | modifica wikitesto]
- per riduzione organica a un elettrodo
- da agenti riducenti leggeri come l'acido ascorbico (vitamina C)[15]
- per radiazione gamma da elettroni solvatati generati in acqua
- trasferimento di elettrone fotoindotto
- riduzione tramite cationi metallici, più comunemente un sale rameoso
- dediazonizzazione anione-indotta: un controione come lo iodio dà trasferimento di elettroni al catione diazonio che forma il radicale arilico e un radicale iodio
- dediazonizzazione solvente-indotta con il solvente come donore di elettroni
Reazioni di grafting(innesto)[modifica | modifica wikitesto]
In una potenziale applicazione in nanotecnologia, il sale di diazonio tetrafluoroborato 4-clorobenzenediazonio molto efficacemente funzionalizza nanotubi a parete singola.[16] Per poter sfogliare i nanotubi, vengono misti con un liquido ionico come un mortaio e pestello. Il sale di diazonio viene aggiunto insieme al carbonato di potassio, e dopo aver macinato la miscela a temperatura ambiente la superficie dei nanotubi è coperta con gruppi clorofenilici con un'efficienza di 1 su 44 atomi di carbonio. Questi gruppi sostituenti aggiuntivi prevengono i tubi dal formare raggruppamenti interni dovuti alla notevole forza coesiva esistente tra loro, questo è un problema ricorrente nella tecnologia dei nanotubi.
È anche possibile funzionalizzare wafer di silicio con sali di diazonio formando un monostrato arile. In uno studio, la superficie di silicio è lavata con idrogenodifluoruro d'ammonio lasciandolo coperto con legami silicio-idrogeno (passivazione idruro).[17] La reazione della superficie con una soluzione di sale di diazonio in acetonitrile per 2 ore nel buio è un processo spontaneo attraverso un meccanismo a radicale libero:[18]

Reazioni di grafting di sali di diazonio su metalli sono state compiute su superfici di ferro, cobalto, nickel, platino, palladio, zinco, rame e oro. È stato riportato anche l'innesto su superfici diamantate.[19] Una domanda interessante sollevata è il posizionamento effettivo del gruppo arile su una superficie. Uno studio in silico[20] dimostra che negli elementi del periodo 4 dal titanio al rame l'energia di legame decresce da sinistra a destra per l'aumento del numero degli elettroni della shell d. I metalli a sinistra del ferro si posizionano inclinati o piatti su una superficie che favorisce la formazione del legame π tra metallo-carbonio e quelli alla destra del ferro sono posizionati in una posizione superiore, favorendo la formazione del legame σ tra metallo-carbonio. Questo spiega anche perché finora il grafting con sale di diazonio è stato possibile con quei metalli a destra del ferro nella tavola periodica degli elementi.
Riduzione a un gruppo idrazina[modifica | modifica wikitesto]
I sali di diazonio possono ridursi con cloruro stannoso (SnCl2) ai corrispondenti derivati dell'idrazina. Questa reazione è particolarmente utile nella sintesi di Fischer dell'indolo dei composti triptani e della molecola indometacina. L'uso di ditionito di sodio è un miglioramento rispetto al cloruro stannoso poiché è un agente di riduzione più economico con meno problemi ambientali.
Applicazioni[modifica | modifica wikitesto]
- Il primo utilizzo dei sali di diazonio consisteva nel produrre tessuti tinti all'acqua immergendo il tessuto in una soluzione acquosa del composto diazonio, seguito da immersione in una soluzione dell'accoppiatore (l'anello ricco di elettroni che subisce la sostituzione elettrofila). Le maggiori applicazioni dei composti del diazonio rimangono nell'industria della tintura e dei pigmenti.[7]
- I composti del diazonio sono reagenti standard usati in sintesi di composti organici, specialmente i composti derivati arilici.
- I sali di diazonio sono sensibili alla luce e si decompongono sotto la vicina UV o luce violetta. Questa proprietà ha portato al loro uso nella riproduzione di documenti. In questo processo, la carta o il film sono rivestiti con un sale di diazonio. Dopo l'esposizione del contatto sotto luce, il diazo residuo viene convertito in un colorante azoico stabile con una soluzione acquosa di accoppiatore. Un processo più comune utilizza una carta rivestita con diazo, accoppiatore e un acido per inibire l'accoppiamento; dopo l'esposizione UV l'immagine è sviluppata da una miscela di vapore di ammoniaca e acqua che forza l'accoppiamento.
Sicurezza[modifica | modifica wikitesto]
Gli alogenuri diazonici solidi sono spesso pericolosamente esplosivi e sono stati segnalati casi di decessi e di feriti.[4]
La natura degli anioni influisce sulla stabilità del sale. I perclorati di arildiazonio, come ad esempio perclorato di nitrobenzenediazonio, sono stati usati nei detonatori per innescare esplosivi.
Note[modifica | modifica wikitesto]
- ^ (EN) Diazonium salt, su britannica.com, Encyclopædia Britannica online.
- ^ (EN) Diazonium salts, su goldbook.iupac.org, IUPAC Gold Book.
- ^ (EN) Victor D. Filimonov, Unusually Stable, Versatile, and Pure Arenediazonium Tosylates: Their Preparation, Structures, and Synthetic Applicability, in Organic Letters, vol. 10, n. 18, 18 settembre 2008, pp. 3961–3964, DOI:10.1021/ol8013528.
- ^ a b UK CRHF Incident Report - Supersaturated Diazonium salt causes Fatality, su crhf.org.uk. URL consultato il 13 May 2010.
- ^ R. V. Hoffman, m-Trifluoromethylbenzenesulfonyl Chloride, in Org. Synth., vol. 60, 1981, p. 121, DOI:10.15227/orgsyn.060.0121.
- ^ K. Hunger. W. Herbst "Pigments, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2012. DOI: 10.1002/14356007.a20_371
- ^ a b Klaus Hunger, Peter Mischke, Wolfgang Rieper, et al. "Azo Dyes" in Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a03_245.
- ^ a b Jim Clark, chemguide, su chemguide.co.uk. URL consultato il 28 September 2011.
- ^ Carlo Galli, Radical reactions of arenediazonium ions: An easy entry into the chemistry of the aryl radical, in Chem. Rev., vol. 88, n. 5, 1988, pp. 765–792, DOI:10.1021/cr00087a004.
- ^ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 978-0-471-60180-7.
- ^ Organic Chemistry, 3, illustrated, Jones & Bartlett Learning, 2004, pp. 535–538, ISBN 978-0-7637-2197-8.
- ^ L. Gattermann, Untersuchungen über Diazoverbindungen, in Berichte der deutschen chemischen Gesellschaft, vol. 23, n. 1, 1894, pp. 1218–1228, DOI:10.1002/cber.189002301199.
- ^ Flood, D. T., Fluorobenzene, in Org. Synth., vol. 13, 1933, p. 46, DOI:10.15227/orgsyn.013.0046..
- ^ Organometallic Diazo Compounds, in Chem. Rev., vol. 93, 1993, pp. 905–1022, DOI:10.1021/cr00019a008.
- ^ Pinacho Crisóstomo Fernando, Ascorbic Acid as an Initiator for the Direct C-H Arylation of (Hetero)arenes with Anilines Nitrosated In Situ, in Angewandte Chemie International Edition, vol. 53, 2014, pp. 2181–2185, DOI:10.1002/anie.201309761.
- ^ Green Chemical Functionalization of Single-Walled Carbon Nanotubes in Ionic Liquids B. Katherine Price, Jared L. Hudson, and James M. Tour J. Am. Chem. Soc.; 2005; 127(42) pp. 14867–14870. DOI: 10.1021/ja053998c
- ^ Direct Covalent Grafting of Conjugated Molecules onto Si, GaAs, and Pd Surfaces from Aryldiazonium Salts, in J. Am. Chem. Soc., vol. 126, n. 1, 2004, pp. 370–8, DOI:10.1021/ja0383120.
- ^ Sequenza della reazione: reazione superficie silicio con idrogenodifluoruro d'ammonio produce uno strato di idruro. Un elettrone viene trasferito dalla superficie del silicio al sale di diazonio in una riduzione di potenziale a circuito aperto che lascia un catione radicale silicio e un radicale diazonio. Nella fase successiva un protone e una molecola di azoto vengono espulsi e i due radicali residui si ricombinano creando un legame superficiale tra silicio e carbonio.
- ^ Chemical Grafting of Biphenyl Self-Assembled Monolayers on Ultrananocrystalline Diamond, in J. Am. Chem. Soc., vol. 128, n. 51, 2006, pp. 16884–91, DOI:10.1021/ja0657049.
- ^ Structure and Bonding between an Aryl Group and Metal Surfaces, in J. Am. Chem. Soc., vol. 128, n. 18, 2006, pp. 6030–1, DOI:10.1021/ja061439f.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «diazonio»
Wikizionario contiene il lemma di dizionario «diazonio»
Collegamenti esterni[modifica | modifica wikitesto]
- Template:Thesaurus BNCF
- W. Reusch, Reactions of Amines, in VirtualText of Organic Chemistry, Michigan State University (archiviato dall'url originale il 12 dicembre 2012).



