Ossido di olmio
| Ossido di olmio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Triossido di diolmio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Ho2O3 |
| Massa molecolare (u) | 377,859 |
| Aspetto | cristalli gialli |
| Numero CAS | |
| Numero EINECS | 235-015-3 |
| PubChem | 4232365 |
| SMILES | O=[Ho]O[Ho]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 8,41 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 2415 °C |
| Temperatura di ebollizione | 3900 °C |
| Indicazioni di sicurezza | |
| Frasi H | --- [1][2] |
| Consigli P | --- |
L'ossido di olmio è un composto chimico di un elemento di terra rara olmio e ossigeno, di formula chimica Ho2O3. Insieme all'ossido di disprosio(III) (Dy2O3), l'ossido di olmio è una delle più potenti sostanze paramagnetiche conosciute. L'ossido, chiamato anche olmia, si presenta come una componente secondaria del minerale di ossido di erbio chiamato erbia. Tipicamente gli ossidi dei lantanidi trivalenti coesistono in natura e la separazione di questi componenti richiede metodi specializzati.
L'ossido di olmio viene utilizzato nella realizzazione di vetri colorati speciali. Il vetro contenente ossido di olmio e soluzioni di ossido di olmio presentano una serie di picchi di assorbimento ottico acuti nell'intervallo spettrale visibile. Sono quindi tradizionalmente utilizzati come comodo standard di calibrazione per spettrofotometri ottici.
Proprietà
[modifica | modifica wikitesto]Aspetto
[modifica | modifica wikitesto]L'ossido di olmio ha alcuni cambi di colore abbastanza drastici a seconda delle condizioni di illuminazione. Alla luce del giorno, è di colore giallo. Sotto luce tricromatica, è un rosso fuoco ardente, quasi indistinguibile dal modo in cui l'ossido di erbio appare sotto la stessa illuminazione. Ciò è legato alle nette bande di emissione dei fosfori.[3] L'ossido di olmio ha un ampio intervallo di banda di 5,3 eV e dovrebbe quindi apparire incolore. Il colore giallo ha origine da abbondanti difetti del reticolo (come le lacune di ossigeno) ed è correlato alle transizioni interne degli ioni Ho3+.[3]
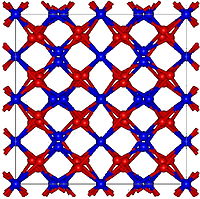
Struttura cristallina
[modifica | modifica wikitesto]L'ossido di olmio ha una struttura cubica, ma piuttosto complessa, con molti atomi per unità di cellula e una grande costante reticolare di 1,06 nm. Questa struttura è caratteristica degli ossidi di elementi pesanti di terre rare, come l'ossido di terbio(III) (Tb2O3), l'ossido di disprosio (Dy2O3), l'ossido di erbio (Er2O3), l'ossido di tulio (Tm2O3), l'ossido di itterbio (Yb2O3) e l'ossido di lutezio (Lu2O3). Il coefficiente di dilatazione termica di Ho2O3 è anche relativamente grande, pari a circa .[4]
Caratteristiche chimiche
[modifica | modifica wikitesto]Il trattamento dell'ossido di olmio con acido cloridrico o con cloruro di ammonio fornisce il corrispondente cloruro di olmio:[5]
Storia
[modifica | modifica wikitesto]L'olmio (da Holmia, nome latino di Stoccolma) fu scoperto da Marc Delafontaine e Jacques-Louis Soret nel 1878, che notarono le anormali bande di assorbimento spettrografico dell'elemento allora sconosciuto (lo chiamarono "Elemento X").[6][7] Più tardi nel 1878, Per Teodor Cleve scoprì indipendentemente l'elemento mentre stava lavorando sulla terra di erbia (ossido di erbio).[8][9]
Utilizzando il metodo sviluppato da Carl Gustaf Mosander, Cleve per prima cosa rimosse tutti i contaminanti noti dall'erbia. Il risultato di quello sforzo furono due nuovi materiali, uno marrone e uno verde. Chiamò la sostanza marrone holmia (dal nome latino della città natale di Cleve, Stoccolma) e quella verde thulia. In seguito si scoprì che l'olmia era l'ossido di olmio e la tulia era ossido di tulio.[10]
Distribuzione
[modifica | modifica wikitesto]L'ossido di olmio si presenta in tracce nei minerali gadolinite, monazite e in altri minerali delle terre rare. L'olmio metallico si ossida facilmente nell'aria. Con il valore di 1,4 mg/kg, l'olmio è il 56º elemento più abbondante nella crosta terrestre.[10] Le principali aree minerarie sono Cina, Stati Uniti, Brasile, India, Sri Lanka e Australia con riserve di ossido di olmio stimate in 400.000 tonnellate.[10]
Produzione
[modifica | modifica wikitesto]Per effettuare l'estrazione dell'ossido di olmio le miscele minerali vengono frantumate e macinate. La monazite, a causa delle sue proprietà magnetiche, può essere separata da ripetute separazioni elettromagnetiche. Dopo la separazione, il materiale viene trattato con acido solforico concentrato caldo per produrre solfati solubili in acqua di numerosi elementi di terre rare. I filtrati acidi sono parzialmente neutralizzati con idrossido di sodio a pH 3-4. Il torio precipita dalla soluzione sotto forma di idrossido e viene rimosso. Successivamente, la soluzione viene trattata con ossalato di ammonio per convertire le terre rare nei loro ossalati insolubili. Gli ossalati vengono convertiti in ossidi mediante ricottura. Gli ossidi vengono disciolti in acido nitrico che esclude uno dei componenti principali, il cerio, il cui ossido è insolubile in HNO3.
La routine di separazione più efficiente per l'ossido di olmio dalle terre rare è lo scambio ionico. In questo processo, gli ioni delle terre rare vengono adsorbiti su un'adeguata resina a scambio ionico mediante scambio con idrogeno, ammonio o ioni rameici presenti nella resina. Gli ioni di terre rare vengono quindi selettivamente eliminati da un idoneo agente complessante, come citrato di ammonio o nitrilotriacetato.[5]
Usi
[modifica | modifica wikitesto]L'ossido di olmio è uno dei coloranti utilizzati per i vetri, a cui conferisce un colore giallo o rosso[11]. Vetri contenenti ossido di olmio e soluzioni di ossido di olmio (generalmente in acido perclorico) hanno stretti picchi di assorbimento ottico nel range 200-900 nm; pertanto sono usati come standard di calibrazione per spettrofotometri ottici[12][13] e sono disponibili commercialmente[14].
Come la maggior parte degli altri ossidi delle terre rare, l'ossido di olmio è usato come catalizzatore e nei laser. Il laser ad olmio opera a una lunghezza d'onda di circa 2,08 micron. Questo laser è sicuro per gli occhi ed è usato in medicina, LIDAR, misure di velocità del vento e monitoraggio dell'atmosfera[15].
Effetti sulla salute
[modifica | modifica wikitesto]L'ossido di olmio(III) è, rispetto a molti altri composti, non molto pericoloso, sebbene una sovraesposizione ripetuta possa causare granuloma ed emoglobinemia. Ha una bassa tossicità orale, cutanea e per inalazione e non è irritante. L'LD50 è maggiore di 1 g per chilogrammo di peso corporeo.[16]
Note
[modifica | modifica wikitesto]- ^ Sostanza non pericolosa secondo la regolamentazione (CE) N. 1272/2008.
- ^ Scheda del composto su Sigma-Aldrich [1]
- ^ a b Su, Yiguo, Guangshe Li, Xiaobo Chen, Junjie Liu e Liping Li, Hydrothermal Synthesis of GdVO4:Ho3+ Nanorods with a Novel White-light Emission, in Chemistry Letters, vol. 37, n. 7, 2008, p. 762, DOI:10.1246/cl.2008.762.
- ^ Singh, H e B Dayal, Precise determination of the lattice parameters of holmium and erbium sesquioxides at elevated temperatures, in Journal of the Less Common Metals, vol. 18, n. 2, 1969, p. 172, DOI:10.1016/0022-5088(69)90137-4.
- ^ a b Pradyot Patnaik, Handbook of Inorganic Chemical Compounds, McGraw-Hill, 2003, pp. 340;445, ISBN 0-07-049439-8. URL consultato il 6 giugno 2009.
- ^ Jacques-Louis Soret, Sur les spectres d'absorption ultra-violets des terres de la gadolinite, in Comptes rendus de l'Académie des sciences, vol. 87, 1878, p. 1062.
- ^ Jacques-Louis Soret, Sur le spectre des terres faisant partie du groupe de l'yttria, in Comptes rendus de l'Académie des sciences, vol. 89, 1879, p. 521.
- ^ Per Teodor Cleve, Sur deux nouveaux éléments dans l'erbine, in Comptes rendus de l'Académie des sciences, vol. 89, 1879, p. 478.
- ^ Per Teodor Cleve, Sur l'erbine, in Comptes rendus de l'Académie des sciences, vol. 89, 1879, p. 708.
- ^ a b c John Emsley, Nature's building blocks: an A-Z guide to the elements, US, Oxford University Press, 2001, pp. 180–181, ISBN 0-19-850341-5.
- ^ Cubic zirconia, su geologyrocks.co.uk. URL consultato il 6 giugno 2009 (archiviato dall'url originale il 24 aprile 2009).
- ^ R. P. MacDonald, Uses for a Holmium Oxide Filter in Spectrophotometry (PDF), in Clinical Chemistry, vol. 10, 1964, p. 1117. URL consultato il 4 marzo 2010 (archiviato dall'url originale il 5 dicembre 2011).
- ^ Travis, John C. et al., An International Evaluation of Holmium Oxide Solution Reference Materials for Wavelength Calibration in Molecular Absorption Spectrophotometry, in Analytical Chemistry, vol. 74, n. 14, 2002, p. 3408, DOI:10.1021/ac0255680, PMID 12139047.
- ^ Holmium Glass Filter for Spectrophotometer Calibration, su labshoponline.com. URL consultato il 6 giugno 2009 (archiviato dall'url originale il 14 marzo 2010).
- ^ Yehoshua Y. Kalisky, The physics and engineering of solid state lasers, SPIE Press, 2006, p. 125, ISBN 0-8194-6094-X.
- ^ External MSDS (PDF), su espimetals.com. URL consultato il 6 giugno 2009 (archiviato dall'url originale il 9 marzo 2008).
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Ossido di olmio
Wikimedia Commons contiene immagini o altri file su Ossido di olmio

