Utente:Grasso Luigi/sanbox1/nitronio
| Ione nitronio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Diossidoazoto(1+)[1] | |
| Caratteristiche generali | |
| Massa molecolare (u) | 46.01 g·mol−1 |
| Numero CAS | |
| PubChem | 3609161 |
| Proprietà termochimiche | |
| S0m(J·K−1mol−1) | 233.86 J K−1 mol−1 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| attenzione | |
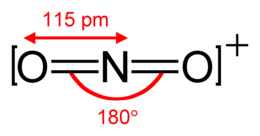
Lo ione nitronio è un catione di formula chimica NO2+ è generalmente molto instabile e prodotto dalla rimozione di un elettrone dal paramagnetico diossido di azoto, o dalla protonazione dell'acido nitrico.
Non è abbastanza stabile per esistere alle condizioni normali, ma è usato estensivamente come un elettrofilo nella nitrazione di altre sostanze. Lo ione è generato quando torna utile miscelando acido solforico e acido nitrico secondo questa reazione:
- H2SO4 + HNO3 → HSO4− + NO2+ + H2O
Lo ione nitronio esiste inoltre in forma solida nel pentossido di diazoto, N2O5, che è un solido ionico formato da ioni nitronio e nitrato. La rispettiva forma liquida e gassosa non contiene ioni nitronio. Lo ione nitronio è isoelettronico con l'anidride carbonica e come questo composto ha una struttura lineare con angoli a 180°.
Lo ione con carica negativa NO−2, l'anione corrispondente, ha il nome di ione nitrito.
Composti ionici e molecolari[modifica | modifica wikitesto]
Vi sono sali (composti ionici) del nitronio stabili con anioni di nucleofilicità debole. Questi composti sono molto igroscopici.[2] Tra questi ci sono:
- Perclorato di nitronio (NO+2ClO−4)
- Tetrafluoroborato di nitronio (NO+2BF−4)
- Esafluorofosfato di nitronio (NO+2PF−6)
- Esafluoroarseniato di nitronio (NO+2AsF−6)
- Esafluoroantimoniato di nitronio (NO+2SbF−6)
Composti molecolari che non sono sali includono:
- Fluoruro di nitrile, NO2F
- Cloruro di nitrile, NO2Cl
Essendo composti molecolari hanno basso punto di ebollizione (−72 °C e −6 °C rispettivamente) e lunghezze dei legami N–X corti (N–F 135 pm, N–Cl 184 pm).[3] Questi composti molecolari si ottengono dalla reazione con il composto stabile diossido di azoto, dove l'atomo centrale N ha [numero di ossidazione] +4 e forma 3 legami con i rispettivi due ossigeni laterali lasciando 1 elettrone libero, considerandolo come un radicale libero detto nitrile (formula -NO2) quando reagisce con F o Cl.
Note[modifica | modifica wikitesto]
- ^ dioxidonitrogen(1+) (CHEBI:29424), in Chemical Entities of Biological Interest (ChEBI), Istituto di Bioinformatica Europeo.
- ^ Kenneth Schofield, Aromatic nitration, CUP Archive, 1980, p. 88, ISBN 0-521-23362-3.
- ^ F. A. Cotton and G.Wilkinson, Advanced Inorganic Chemistry, 5th edition (1988), Wiley, p.333
Voci correlate[modifica | modifica wikitesto]
Categoria:ossianioni [[:Categoria:cationi]] [[:Categoria:ossicationi]] [[:Categoria:Composti dell'azoto|Composti del nitronio]] [[:Categoria:Gruppi funzionali]]