Distrofia miotonica
| Distrofia miotonica | |
|---|---|
 | |
| Malattia rara | |
| Cod. esenz. SSN | RFG090 |
| Specialità | neurologia |
| Eziologia | mutazione |
| Classificazione e risorse esterne (EN) | |
| OMIM | 160900 |
| MeSH | D009223 |
| GeneReviews | Panoramica e Panoramica |
| Sinonimi | |
| Miotonia distrofica | |
| Eponimi | |
| Hans Gustav Wilhelm Steinert Kenneth Ricker | |
La distrofia miotonica (DM) è una malattia genetica neuromuscolare degenerativa a carattere autosomico dominante, caratterizzata da un quadro clinico ampiamente variabile e da un decorso lentamente progressivo, il cui esordio può avvenire a qualunque età. Rappresenta la seconda forma di distrofia muscolare più diffusa dopo la distrofia muscolare di Duchenne.
I pazienti con distrofia miotonica di tipo 1 (DM1) o malattia di Steinert, tranne che nella forma tardiva (dell'adulto, più favorevole), e quella congenita o infantile (più grave) hanno un'aspettativa di vita più bassa, ridotta in media di 10 anni[1], essendo soggetti ad aritmia grave e cardiomiopatia (che possono esitare in morte cardiaca improvvisa), e a disturbi respiratori seri. Nella distrofia miotonica di tipo 2, detta anche miopatia miotonica prossimale (DM2 o PROMM) o di malattia di Ricker (esordio adulto) - da non confondere con un omonima atassia cerebellare - l'aspettativa di vita del paziente può anche essere normale.
Il quadro clinico è caratterizzato da perdita di massa muscolare (miopatia con ipotrofia), miotono, cataratta (circa metà dei casi di DM1), difetti nel sistema di conduzione cardiaco, alterazioni endocrine e deficit cognitivi nei casi congeniti infantili di DM1. È presente nella DM1 un fenomeno di anticipazione per cui l'esordio tende a presentarsi ad un'età sempre più giovane di generazione in generazione nella stessa famiglia.
Epidemiologia[modifica | modifica wikitesto]
La prevalenza è stata calcolata intorno ad 1 su 8.000 persone.[2][3]
Classificazione[modifica | modifica wikitesto]
Esistono varie forme di distrofia miotonica riconoscibili mediante l'esame del DNA:
- Distrofia miotonica di tipo 1 (DM1), detta anche malattia di Steinert, individuata nel 1909,[4] che può avere un esordio precoce nei lattanti e bambini.
- Distrofia miotonica di tipo 2 (DM2) o PROMM (proximal myotonic myopathy), detta anche malattia di Ricker, ovvero la forma più benigna, scoperta nel 1994.
Il 98% circa di tutti i casi di distrofia miotonica rientrano nel tipo 1, ad ogni modo il tipo 2 è caratterizzato da presentazione atipica e fenotipi insoliti, con sintomi diversi dalla forma classica, e sintomatologia ibrida, pertanto verosimilmente la diagnosi è sottostimata. È risultato molto più diffuso in Germania e tra le persone con origini tedesche.
Gli specialisti stanno attualmente indagando sull'esistenza di altri tipi di distrofia miotonica, ad esempio si ipotizzava una forma grave dell'età matura collegata alla demenza frontotemporale, ma poi collegata geneticamente alla malattia ossea di Paget. La DM1 esordisce a diverse età[5]:
- congenita, dalla nascita
- infantile, intorno ai 10 anni
- classica (giovanile-preadolescenziale), tra 10 e i 30 anni
- lieve (dell'adulto o tardiva), tipicamente intorno o dopo i 40 anni, ma è possibile dai 20 ai 70[6]
La DM2 esordisce tipicamente tra i 40 e i 50 anni, spesso intorno ai 48, tuttavia sono stati osservati casi dai 20 ai 70 anni.[7]
La miotonia può precedere la debolezza e la malattia vera e propria di molti anni.
Genetica[modifica | modifica wikitesto]
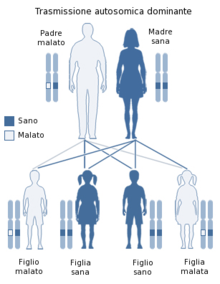
La Distrofia Miotonica è una malattia genetica a trasmissione autosomica dominante, pertanto si sviluppa in seguito all'acquisizione del gene affetto da un genitore. La probabilità di ereditare il gene affetto è del 50%.
La DM è caratterizzata dalla presenza di triplette nucleotidiche ripetute. Le ripetizioni di coppie o triplette nucleotidiche sono frequenti nel DNA, ma in questa patologia le ripetizioni sono in numero esagerato rispetto alle ripetizioni presenti nel DNA normale; questo fenomeno prende il nome di "amplificazione". Negli ultimi anni sono state identificate numerose malattie a trasmissione genetica in cui il meccanismo di danno è legato alla presenza di ripetizione di triplette, la prima ad essere studiata e la più nota fu la Corea di Huntington che condivide con la distrofia miotonica la caratteristica di esordire più precocemente ad ogni generazione successiva.
DM1[modifica | modifica wikitesto]
Nella forma DM1 (malattia di Steinert) il gene mutato è chiamato DMPK (myotonic dystrophy protein kinase) e codifica per una miosin chinasi espressa nei muscoli scheletrici. Questo gene è localizzato nel braccio lungo del cromosoma 19 (in posizione 19q13.3). In questo locus vi è un difetto molecolare specifico, costituito da una sequenza trinucleotidica instabile (Citosina Timina Guanina) nel 3'UTR che viene ripetuta 50-4000 volte quando nella popolazione normale il range varia da 5 a 37 volte.
DM2[modifica | modifica wikitesto]

Nella forma DM2 (detta anche miopatia miotonica prossimale/PROMM o malattia di Ricker) analogamente c'è un difetto nel gene ZNF9 sul cromosoma 3 in posizione 3q21. Il numero di ripetizioni va da 75 ad oltre 11000, ma in questo caso non sembra esserci differenza nella gravità della patologia o nella precocità di esordio. Il fenomeno dell'anticipazione in questa forma sembra essere meno significativo e in letteratura è riferita solo una lieve anticipazione. In questo caso la ripetizione coinvolge quattro nucleotidi.[8] Recenti studi hanno ipotizzato anche una disfunzione mitocondriale nella DM2.[9]
Fenotipi[modifica | modifica wikitesto]
È un esempio di eterogeneità genetica: sono interessati altri geni responsabili della merosina e non la distrofina come nello DMD e BMD), ma hanno lo stesso quadro fenotipico di espressione simili. Sono presenti 4 fenotipi:
- Classico: 60% in paesi occidentali con ipodensità della sostanza bianca e dilatazione dei ventricoli e lo sviluppo intellettivo nella norma.
- Fukuyama: nei paesi asiatici con presenza di attivazione strutturale nel cervello, ritardo normale e epilessia.
- Cerebro-muscolo-oculare: con presenza di disturbi neurologici e oculari e grave ritardo mentale.
- Walker-Warburg: più severa dal p.v. neurologico.
Oltre all'alterazione dei geni che causano la distrofia muscolare, ovvero la perdita di fibra muscolare sostituita da tessuto adiposo, vi è la miotonia chr è correlata con l'alterazione deldel gene CLCN1, che codifica un canale del cloro attivo a livello muscolare, in maniera somigliante alle altre canalopatie del cloro (come nella miotonia congenita di Becker). Questa alterazione porta alla formazione di una forma tronca del canale che viene quindi eliminato.
Quadro clinico[modifica | modifica wikitesto]
Il quadro clinico è variabile, con la costante della miotonia. Nella DM1 le principali caratteristiche sono inoltre la debolezza muscolare progressiva e l'aritmia, mentre nella DM2 il dolore muscolare, una debolezza minore e la facile stanchezza con intolleranza allo sforzo.
Frequente nella DM1 il riscontro di miopatia, disartria, atrofia muscolare, ipotiroidismo, ritardo mentale (solo se esordio infantile), molto grave può essere il coinvolgimento del miocardio[10] portando a forme di cardiomiopatia diffusa.[11] La forma congenita e quella infantile sono gravi, mentre lo sono meno la forma giovanile-preadolescenziale e quella dell'adulto. La forma meno grave è la tardiva.
Nella DM2 si osservano frequentemente nistagmo,[12] disfagia e dolore addominale[13] mentre nella DM1 si osservano disturbi dello spettro autistico fra cui la sindrome di Tourette (i disturbi da tic sono presenti a volte anche nella DM2).[14] I pazienti con DM2 si presentano riferendo un quadro miopatico di dolori muscolari (a volte con crampi, spasmi, contratture, strappi), affaticabilità, astenia, rigidità, debolezza ai muscoli prossimali dell'arto inferiore (coscia) e superiore (deltoide, trapezio).[15] La forma meno grave è chiamata miopatia miotonica prossimale. Si possono verificare nella DM2 sintomi affini a quelli di sciatica, radicolite, osteoartrite, e fibromialgia.[16]
La DM presenta spesso anche problemi endocrini (ipotiroidismo e ipertiroidismo, diabete mellito), cataratta precoce, problemi gastrointestinali (disfagia, dispepsia, nausea, come detto dolore addominale, e dissenteria o stipsi, in un quadro simile al colon irritabile[17]), ipersonnia, disturbi psichiatrici (ansia, depressione, insonnia), problemi respiratori, calvizie parziale-frontale non androgenetica. Come rilevato i disturbi del sonno sono tipicamente presenti. L'apnea centrale del sonno o l'apnea ostruttiva del sonno può causare eccessiva sonnolenza diurna e questi individui dovrebbero sottoporsi a uno studio del sonno. Uno studio ha evidenziato che il 26 % del pazienti DM2 presenta malattie autoimmuni.[18] Alcuni studi indicano anche un aumento del rischio di cancro.[19]
La distribuzione della debolezza muscolare è diversa per le due forme: nella DM1 sono affette le masse muscolari del volto e della mandibola, con ptosi palpebrale, debolezza dei muscoli del collo, delle mani e della parte distale della gamba (piede). Nella DM2 la debolezza è più evidente (ma non esclusiva) ai muscoli prossimali, quindi vicino al tronco: nuca, spalle, schiena, flessori dell'anca e parte superiore delle gambe. La ptosi può essere presente in modo meno evidente così come la debolezza minore di mani, piedi e muscoli di collo e mandibola. La miotonia in entrambe le forme solitamente è peggiore col freddo e migliora con il movimento. L'intolleranza al calore e all'umidità, e l'ipersudorazione, sono frequenti nella DM2, più leggere o assenti nella DM1.[20]
L'atrofia dei masseteri porta ad un assottigliamento della metà inferiore della faccia e alla malposizione della mandibola e malocclusione dentale. Gli sternocleidomastoidei sono quasi sempre assottigliati e indeboliti con conseguente curvatura inferiore del collo (collo a cigno).
La debolezza dei muscoli della faringe e della laringe determina una voce debole e monotona. Frequenti sono la debolezza del diaframma e l'ipoventilazione alveolare con bronchite cronica.
Diagnosi[modifica | modifica wikitesto]
La diagnosi di distrofia miotonica può essere difficile poiché comporta la diagnosi differenziale con le patologie neuromuscolari che condividono alcuni aspetti del quadro clinico, tramite clinica, elettromiografia, biopsia muscolare ed esami genetici. Le patologie neuromuscolari sono perlopiù rare ed attualmente se ne conoscono oltre 40 che diventano 100 se si prendono in considerazione i sottotipi. Perciò un paziente con un quadro clinico complesso che potrebbe essere affetto da DM dovrà essere indirizzato ad uno specialista, ma a seconda del sintomo d'esordio il paziente potrebbe essere indirizzato ad un neurologo, ad un cardiologo, ad un oculista, ad un endocrinologo o ad un reumatologo. Poiché la presentazione è frequentemente atipica è possibile che se non viene interpellato un esperto di patologie neuromuscolari la diagnosi non venga eseguita.
Nonostante non esistano ad oggi cure specifiche per la DM e la terapia sia basata su interventi sintomatici (si affrontano i problemi mano a mano che si presentano), è importante che la diagnosi venga formulata correttamente, sia per monitorare il paziente e poter riconoscere precocemente le manifestazioni più gravi e potenzialmente fatali (ad esempio i problemi cardiaci), sia per fornire una consulenza genetica rispetto all'elevato rischio di trasmissione alla prole.
Il rischio anestesiologico è tale per cui la presenza di DM deve essere riferita ad ogni visita medica, anche per problemi non correlati alla patologia.
La diagnosi di certezza si ha mediante l'esame del DNA.
Terapia[modifica | modifica wikitesto]
Non esistono trattamenti efficaci contro tale forma di distrofia muscolare, per combattere in parte la miotonia si somministra la mexiletina (dosi 75 mg - 150 mg).[21]
L'attenzione si concentra sulla gestione delle complicanze della malattia, in particolare quelle relative al sistema cardiopolmonare in quanto rappresentano il 70% dei decessi dovuti a DM1.[22] L'inserimento di pacemaker può essere richiesto per soggetti con anomalie della conduzione cardiaca. Il miglioramento della qualità della vita che può essere misurato utilizzando questionari specifici[23] è anche un obiettivo principale delle cure mediche.
Alcuni piccoli studi hanno suggerito che l'imipramina, la clomipramina e la taurina possono essere utili nel trattamento della miotonia.[22] Tuttavia, a causa della debole evidenza e dei potenziali effetti collaterali come aritmie cardiache, questi trattamenti sono usati raramente. Un recente studio del dicembre 2015 ha dimostrato che un comune antibiotico approvato dalla FDA, l'eritromicina ha ridotto la miotonia nei topi.[24] Sono previsti studi sull'uomo per l'eritromicina. L'eritromicina è stata utilizzata con successo in pazienti con problemi gastrici.[25] La ventilazione assistita non invasiva può essere offerta in caso di anomalie respiratorie.
È stato dimostrato che lo splicing alterato del canale 1 specifico per il muscolo (ClC-1) causa il fenotipo miotonico di DM1 ed è reversibile nei modelli murini che utilizzano l'antisenso morfolino per modificare lo splicing dell'mRNA di ClC-1.[26]
Come le altre miopatie e distrofie, importante anche la gestione dei sintomi come il dolore, la fatica, il mantenimento delle funzioni di movimento attraverso esercizio fisico non pesante, i problemi neurologici, sistemici, psicologici, e quelli muscolo-scheletrici derivati dalla debolezza, con trattamenti di supporto, farmacologici e fisioterapia. Nella DM2 dove il dolore muscolare è uno dei sintomi principali, si usano antinfiammatori non steroidei (es. ibuprofene), miorilassanti e anticonvulsivanti (gabapentin, pregabalin, utili anche contro il fenomeno miotonico) unitamente ad antidepressivi che agiscono sulla soglia del dolore (es. duloxetina, amitriptilina, nortriptilina). È stato ipotizzato l’uso medico della cannabis, ma mancano studi controllati.[27][28]
Prognosi[modifica | modifica wikitesto]
La prognosi nella DM1 è infausta (tranne nella forma DM1 tardiva), con aspettativa di vita ridotta di 10 anni in media[1]; il rischio di morte è più elevato nella tipologia 1 dato che è più soggetta ad aritmie fatali che causano morte improvvisa per torsione di punta, tachicardia, bradicardia o scompenso cardiaco acuto. Come detto, installazioni di pacemaker ma anche di defibrillatore impiantabile possono essere fondamentali per salvare la vita del paziente. L'incidenza di morte improvvisa è del 2-30%, secondo i dati della letteratura, ed è stata osservata anche nei portatori di pacemaker, la cui prevalenza nella DM1 è del 3-22%.[29]
La DM2 è meno soggetta a morte cardiaca improvvisa della DM1 e alla cardiomiopatia.
Altre cause di decesso sono la polmonite e l'insufficienza respiratoria acuta, le infezioni, le malattie correlate all'aspetto sistemico della DM, o le complicanze di interventi chirurgici, ma non direttamente la debolezza dei muscoli respiratori (come nelle distrofinopatie).[30]
La forma tardiva di DM1 è a volte asintomatica, mentre la forma miopatia miotonica prossimale di DM2 ha coinvolgimento cardiaco raro o più tardivo e prognosi migliore.[31] La malattia progredisce lentamente, con interessamento graduale dei muscoli prossimali degli arti e del tronco. La maggior parte dei pazienti con DM1 è confinata in carrozzella o a letto entro 15-20 anni dall'esordio. Generalmente i pazienti con DM2 necessitano molto meno di dispositivi di assistenza (bastoni, stampelle, deambulatori, sedie a rotelle, scooter per disabili ecc.) rispetto ai pazienti con DM1, sebbene incontrino difficoltà crescenti salire le scale man mano che la malattia progredisce e talvolta possono essere segnalati cadute o inciampi, e possono sentirsi più a loro agio con l'aiuto di supporti.[32]
L'aspettativa di vita media di un paziente è generalmente più bassa, può essere però normale nelle due forme più lievi, DM1 tardiva e DM2, specie nella DM2.[33] Nella DM1 ad esordio giovanile e adulto-tardivo, è stata osservata una mediana di sopravvivenza di 55-60 anni per gli uomini e 55-59 anni per le donne[34], mentre è massimo 45-50 anni nella forma congenita o infantile. Altri studi indicano una vita media nello standard per i pazienti con la forma lieve (adulta e tardiva).[6] Nella DM2, di prognosi più buona, non vi sono sufficienti studi sulla sopravvivenza media ma dai dati disponibili è ritenuta essere più o meno nella norma della popolazione generale, in assenza di gravi disturbi cardiaci, indipendentemente dall'età di esordio.[7]
Note[modifica | modifica wikitesto]
- ^ a b "Distrofia miotonica di Steinert" su Orphanet. Articoli citati:
*Harper PS, van Engelen B, Eymard B, Wilcox DE: Myotonic Dystrophy: present managment, future therapy. Oxford: Oxford University Press 2004.
*Lazarus A, Varin J, Ounnoughene Z, Radvanyi H, Junien C, Coste J, Laforet P, Eymard B, Becane HM, Weber S, Duboc D: Relationships among electrophysiological findings and clinical status, heart function, and extent of DNA mutation in myotonic dystrophy. Circulation 1999, 99:1041-1046.
*Groh WJ, Groh MR, Saha MSC, Kincaid JC, Simmons Z, Ciafaloni E, Pourmand R, Otten RF, Bhakta D, Nair GV, Marashdeh MM, Zipes DP, Pascuzzi RM: Electrocardiographic abnormalities and sudden death in myotonic dystrophy Type 1. N Engl J Med 2008, 358:2688-97. - ^ Antonio Cao, Malattie genetiche. Molecole e geni. Diagnosi, prevenzione e terapia, Padova, Piccin, febbraio 2004 [2004].
- ^ (EN) Genetics Home Reference, Myotonic dystrophy, su Genetics Home Reference. URL consultato il 10 dicembre 2018.
- ^ Steinberg H, Wagner A., Hans Steinert: 100 years of myotonic dystrophy, in Cardiol Prat., vol. 79, agosto 2008, pp. 961-70.
- ^ Myotonic Dystrophy
- ^ a b Turner, C. & Hilton-Jones, D. Myotonic dystrophy: Diagnosis, management and new therapies. Current Opinion in Neurology (2014). doi:10.1097/WCO.0000000000000128
- ^ a b Day, J. W. et al. Myotonic dystrophy type 2: Molecular, diagnostic and clinical spectrum. Neurology (2003). doi:10.1212/01.WNL.0000054481.84978.F9
- ^ Liquori CL, Ricker K, Moseley ML, et al., Myotonic dystrophy type 2 caused by a CCTG expansion in intron 1 of ZNF9, in Science (journal), vol. 293, n. 5531, agosto 2001, pp. 864–7, DOI:10.1126/science.1062125, PMID 11486088.
- ^ [https://www.fondazionemalattiemiotoniche.org/disfunzione-funzionale-e-strutturale-mitocondriale-nella-dm2 Disfunzione funzionale e strutturale mitocondriale nella DM2 Nuovi Progressi Nella Ricerca Sulla DM2. Un'anomalia Mitocondriale Potrebbe Essere Coinvolta Nella Manifestazione Clinica Della DM2.] - fondazionemalattiemiotoniche
- ^ Sá MI, Cabral S, Costa PD, Coelho T, Freitas M, Torres S, Gomes JL., Cardiac involveent in type 1 myotonic dystrophy, in Rev Port Cardiol., vol. 27, 2007, pp. 829-840.
- ^ McDonnell M, Alcantar J, Wachsner RY, Meymandi SK., Cardiomyopathy and multiple pulmonary emboli in a patient with myotonic dystrophy, in Congest Heart Fail., vol. 14, 2008, pp. 106-110.
- ^ Ajroud-Driss S, Sufit R, Siddique T, Hain TC., Oculomotor involvement in myotonic dystrophy type 2., in Muscle Nerve., 2008.
- ^ Tieleman AA, van Vliet J, Jansen JB, van der Kooi AJ, Borm GF, van Engelen BG., Gastrointestinal involvement is frequent in Myotonic Dystrophy type 2., in Neuromuscul Disord., vol. 18, agosto 2008, pp. 646-649.
- ^ Ekström AB, Hakenäs-Plate L, Samuelsson L, Tulinius M, Wentz E.., Autism spectrum conditions in myotonic dystrophy type 1: a study on 57 individuals with congenital and childhood forms., in Am J Med Genet B Neuropsychiatr Genet., 147B, 2008, pp. 918-926.
- ^ (Day & al, 2003).
- ^ Myotonic dystrophy type 2: the 2020 update
- ^ Dolore addominale e problemi intestinali
- ^ Malattie autoimmuni nei pazienti con DM2
- ^ Gadalla, S. M. et al. Cancer risk among patients with myotonic muscular dystrophy. JAMA - J. Am. Med. Assoc. (2011). doi:10.1001/jama.2011.1796
- ^ Myotonic Dystrophy - Anesthesiology
- ^ Research Laboratories Merck, The Merck Manual quinta edizione Pag 2600, Milano, Springer-Verlag, 2008, ISBN 978-88-470-0707-9.
- ^ a b (EN) Chris Turner e David Hilton-Jones, The myotonic dystrophies: diagnosis and management, in Journal of Neurology, Neurosurgery & Psychiatry, vol. 81, n. 4, 1º aprile 2010, pp. 358–367, DOI:10.1136/jnnp.2008.158261. URL consultato l'11 giugno 2020.
- ^ (EN) Antoine Dany, Coralie Barbe e Amandine Rapin, Construction of a Quality of Life Questionnaire for slowly progressive neuromuscular disease, in Quality of Life Research, vol. 24, n. 11, 1º novembre 2015, pp. 2615–2623, DOI:10.1007/s11136-015-1013-8. URL consultato l'11 giugno 2020.
- ^ Masayuki Nakamori, Katarzyna Taylor e Hideki Mochizuki, Oral administration of erythromycin decreases RNA toxicity in myotonic dystrophy, in Annals of Clinical and Translational Neurology, vol. 3, n. 1, 10 dicembre 2015, pp. 42–54, DOI:10.1002/acn3.271. URL consultato l'11 giugno 2020.
- ^ (EN) A. Rönnblom, S. Andersson e P. M. Hellström, Gastric emptying in myotonic dystrophy, in European Journal of Clinical Investigation, vol. 32, n. 8, 2002, pp. 570–574, DOI:10.1046/j.1365-2362.2002.01028.x. URL consultato l'11 giugno 2020.
- ^ Thurman M. Wheeler, John D. Lueck e Maurice S. Swanson, Correction of ClC-1 splicing eliminates chloride channelopathy and myotonia in mouse models of myotonic dystrophy, in The Journal of Clinical Investigation, vol. 117, n. 12, 3 dicembre 2007, pp. 3952–3957, DOI:10.1172/JCI33355. URL consultato l'11 giugno 2020.
- ^ Il dolore nella Distrofia Miotonica di tipo 2 (DM2): dove è localizzato e come va trattato?
- ^ Montagnese F., Current treatment options for patients with myotonic dystrophy type 2. Curr Treat Options Neurol 2021;23:31
- ^ VALUTAZIONE DEL RISCHIO ARITMICO NELLA DISTROFIA MIOTONICA TIPO 1 (DM1) - Fondazione Telethon
- ^ Consensus-based care recommendations for adults with myotonic dystrophy type 1". Neurology. Clinical Practice. 8 (6): 507–520. doi:10.1212/CPJ.0000000000000531. PMC 6294540. PMID 30588381.
- ^ Proximal myotonic myopathy
- ^ Turner C, Hilton-Jones D (April 2010). "The myotonic dystrophies: diagnosis and management". J. Neurol. Neurosurg. Psychiatry. 81 (4): 358–67. doi:10.1136/jnnp.2008.158261. PMID 20176601.
- ^ Groh WJ, Groh MR, Saha C, Kincaid JC, Simmons Z, Ciafaloni E, Pourmand R, Otten RF, Bhakta D, Nair GV, Marashdeh MM, Zipes DP, Pascuzzi RM., Electrocardiographic abnormalities and sudden death in myotonic dystrophy type 1., in N Engl J Med., vol. 358, giugno 2008, pp. 2688-2697.
- ^ Age and causes of death in adult-onset myotonic dystrophy
Bibliografia[modifica | modifica wikitesto]
- Joseph C. Segen, Concise Dictionary of Modern Medicine, New York, McGraw-Hill, 2006, ISBN 978-88-386-3917-3.
- Douglas M. Anderson, A. Elliot Michelle, Mosby’s medical, nursing, & Allied Health Dictionary sesta edizione, New York, Piccin, 2004, ISBN 88-299-1716-8.
Voci correlate[modifica | modifica wikitesto]
- Miotonia
- Distrofia muscolare
- Miopatia
- Malattie da espansione di triplette
- Sindrome di Andersen-Tawil
- Miotonia congenita
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su distrofia miotonica
Wikimedia Commons contiene immagini o altri file su distrofia miotonica
Collegamenti esterni[modifica | modifica wikitesto]
- Searchable database Archiviato il 17 ottobre 2008 in Internet Archive. at Dutch Neuromuscular Research
- 140th ENMC International Workshop 2006 Myotonic Dystrophy DM2/PROMM and other Myotonic dystrophies]
- Disease Information from the Myotonic Dystrophy Foundation
- Information from the International Myotonic Dystrophy Organization
- MDSG Information, su mdsguk.org. URL consultato il 26 agosto 2009 (archiviato dall'url originale il 29 dicembre 2008).
- Information from the Neuromuscular Disease Center
- DM Toolbox Research tools for Myotonic Dystrophy from the Marigold Foundation
| Controllo di autorità | Thesaurus BNCF 43723 · LCCN (EN) sh85089286 · BNE (ES) XX4435101 (data) · BNF (FR) cb12268952p (data) · J9U (EN, HE) 987007555749205171 |
|---|
