Complessi K
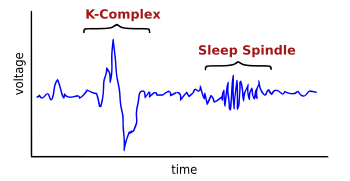
I complessi K sono forme d'onda di alto voltaggio rilevabili in un elettroencefalogramma (EEG) e si verificano durante la fase 2 del sonno non-REM. Sono stati definiti il "più grande evento nell'elettroencefalogramma di un uomo sano".[1] Questi complessi sono più frequenti nei primi cicli di sonno.
Si ritiene che i complessi K assolvano ad almeno due funzioni: in primo luogo, sembra determinano la soppressione dell'eccitazione corticale in risposta a stimoli che il cervello addormentato non ritiene debbano essere valutati come pericolosi, e la seconda, favoriscono il consolidamento della memoria basato sul sonno. Il complesso K è stato scoperto nell'anno 1937 nei laboratori privati di Alfred Lee Loomis.[2]
Neurofisiologia[modifica | modifica wikitesto]
I complessi K sono costituiti da onde elettroencefalografiche che si caratterizzano per una fase rapida negativa con fronte di risalita altrettanto rapido, ad alta tensione, generalmente maggiore di 100 microV (come dice K EEG max 100-200 microvolt), seguite da un lento complesso positivo intorno 350 e 550 ms a 900 ms e un picco negativo finale. Tale onda assume la forma della lettera K e da questa prende il nome. I complessi K, indicativi dello stadio 2 del sonno, si verificano all'incirca ogni 1,0-1,7 minuti e sono spesso seguiti da fusi del sonno. Essi si verificano spontaneamente[1] ma possono anche verificarsi in risposta a stimoli esterni come suoni o tocchi sulla cute[3] e di stimoli interni, come le interruzioni dell'inspirazione.[4] I complessi sono generati diffusamente in sede corticale[1] anche se tendono a prevalere nelle regioni frontali del cervello.[5] Sia i complessi K che l'attività delle onde delta nella fase 2 del sonno creano oscillazioni a onde lente (0,8 Hz) e delta (1,6-4,0 Hz). Tuttavia, la loro distribuzione topografica è diversa, e la potenza dei complessi K è maggiore.[6]
I complessi si formano a seguito del verificarsi in zone diffuse di aree corticali di correnti dendritiche a partenza dal centro (III) verso gli strati superiori (I) della corteccia cerebrale.
Questo fenomeno è accompagnato da una diminuzione dell'attività EEG a banda larga, comprese l'attività delle onde gamma. Questa situazione produce "down-states" di silenzio neuronale in cui l'attività della rete neurale viene ridotta.[1]
L'attività dei complessi K viene trasferita al talamo dove produce una sincronizzazione della rete talamocorticale durante il sonno, producendo le oscillazioni tipiche del sonno quali i fusi del sonno e le onde delta.[7]
È stato osservato che sono effettivamente identici nella "distribuzione laminare delle correnti transmembrana" alle onde del sonno lento.[1]
È stato suggerito che i complessi K siano utili sia nel "proteggere" la fase del sonno, sia nel determinare l'elaborazione delle informazioni, in quanto sono entrambe una parte essenziale della sincronizzazione del sonno non-REM. Nel contempo essi rispondono in modo reattivo a stimoli interni ed esterni.[8]
Questo aspetto sarebbe coerente con una loro funzione nel sopprimere l'eccitazione corticale in risposta a stimoli che il cervello deve inizialmente elaborare e classificare come pericolosi o meno.[1]
Un'altra funzione dei complessi K consisterebbe nell'aiutare l'omeostasi sinaptica[9] (cioè il mantenimento dell'efficienza ed agilità delle sinapsi) e nel consolidare la memoria. Le soglie di attivazione delle sinapsi corticali si riducono infatti durante la veglia per la necessità di elaborare le informazioni, rendendole più reattive. Da qui la necessità di una ritorno ad una regolazione (attivazione) più bassa per preservare il corretto rapporto segnale-rumore.[9]
Sembra che i complessi K favoriscano una minore attivazione sinaptica riducendo la forza delle connessioni sinaptiche che si attivano quando un individuo è sveglio.[1]
Inoltre, la ripresa dello stato di bassa attivazione indotto dai complessi K permette che "l'attivazione (scarica) corticale si ripristini in un ordine sistematico" in modo che gli engrammi di memoria codificati durante la scarica neuronale possano essere "ripetutamente praticati e quindi consolidati".[1]
Sviluppo[modifica | modifica wikitesto]
I complessi K sono già presenti nel corso del sonno in bambini di 5 mesi di età, e si sviluppano con l'accrescimento. Tra i 3 ed i 5 anni, una componente negativa più veloce inizia ad apparire e continua ad aumentare fino all'adolescenza. Negli adulti si registra un altro cambiamento: prima dei 30 anni di età la frequenza e l'ampiezza dei complessi è superiore rispetto a quanto si verifica nelle persone anziane, in particolare di quelli oltre i 50 anni di età.[10] Questo avviene in parallelo con la diminuzione di altre componenti del sonno come la densità dei fusi del sonno e le onde delta.[10]
Oltre alla diminuzione fisiologica dei complessi K a causa del progredire dell'età, un gruppo di neuroscienziati italiani coordinati da Luigi De Gennaro ha dimostrato la presenza di una diminuzione patologica causata dalla malattia di Alzheimer, e che tale diminuzione risulta correlata con l'entità del declino cognitivo misurato su ciascun paziente. La scoperta è stata considerata promettente per la diagnosi precoce della malattia, diagnosi che potrebbe quindi essere tratta per il tramite di questo biomarcatore, caratteristico del sonno NREM[11][12]. Questo fenomeno di drastica riduzione dei complessi K nelle malattie neurodegenerative e, più in generale nelle patologie neurologiche associate a un'alterazione dell'α-sinucleina, è stata riscontrata anche nel disturbo comportamentale del sonno REM. I pazienti con questo disturbo, e che presentano declino cognitivo e una probabilità più elevata di conversione in una sinucleinopatia[13], hanno una significativa perdita dei complessi K, a conferma del loro ruolo di indicatori di fasi prodromiche delle malattie con alterazione dell'α-sinucleina[14].
Clinica[modifica | modifica wikitesto]
Epilessia[modifica | modifica wikitesto]
Negli individui con epilessia generalizzata idiopatica, la sincronizzazione indotta dai complessi K può innescare delle scariche punta-onda. Questo fatto si verifica con maggiore facilità al momento di passaggio tra la veglia e il sonno non REM, e tra le fasi non REM e REM del sonno.[15]
Nell'epilessia del lobo frontale autosomica dominante notturna, i complessi K sono quasi sempre presente all'inizio delle crisi epilettiche.[16]
Sindrome delle gambe senza riposo[modifica | modifica wikitesto]
Negli individui affetti da sindrome delle gambe senza riposo (RLS) il numero di complessi K risulta aumentato e questi si associano e spesso precedono i movimenti delle gambe. I farmaci che aumentano le concentrazioni di dopamina, come ad esempio la L-dopa, e che sono efficaci nel ridurre i movimenti delle gambe, non riducono i complessi K suggerendo che questi ultimi sono primari mentre i movimenti delle gambe sono probabilmente una conseguenza.
I pazienti trattati con questo tipo di farmaci vedono ridursi i movimenti delle gambe ma non i complessi K e nonostante il trattamento continuano a lamentare una scarsa qualità del sonno.[17]
Anche clonazepam è stato suggerito come trattamento per la RLS. Come altre benzodiazepine, clonazepam inibisce il sonno REM aumentando le concentrazioni di GABA. Questa inibizione del sonno REM diminuisce significativamente la quantità di complessi K, e a differenza del trattamento con L-DOPA, gli studi effettuati con clonazepam hanno evidenziato un miglioramento del sonno ristoratore. Pertanto, i farmaci che inibiscono il sonno REM riducono anche il numero dei complessi K.
Apnea ostruttiva del sonno[modifica | modifica wikitesto]
La sindrome da apnea ostruttiva del sonno è associata ad occlusioni inspiratorie che determinano una riduzione dei complessi K durante il sonno non REM, anche se i complessi K sono evocati normalmente dagli stimoli uditivi e tali individui reagiscono normalmente alle interruzioni respiratorie quando svegli. Questo fatto suggerisce una stretta correlazione tra l'apnea ostruttiva del sonno ed una ridotta, sonno specifica, risposta corticale per tali problemi respiratori.[18][19][20]
Altre immagini[modifica | modifica wikitesto]
-
Aspetto di alcuni complessi K
Note[modifica | modifica wikitesto]
- ^ a b c d e f g h SS. Cash, E. Halgren; N. Dehghani; AO. Rossetti; T. Thesen; C. Wang; O. Devinsky; R. Kuzniecky; W. Doyle; JR. Madsen; E. Bromfield, The human K-complex represents an isolated cortical down-state., in Science, vol. 324, n. 5930, maggio 2009, pp. 1084-7, DOI:10.1126/science.1169626, PMID 19461004.
- ^ A.L. Loomis, Harvey, E.N.; Hobart, G.A., Cerebral states during sleep as studies by human brain potentials (abstract), in J Exp Psychol, vol. 21, 1937, pp. 127-44.
- ^ M. Roth, J. Shaw; J. Green, The form voltage distribution and physiological significance of the K-complex., in Electroencephalogr Clin Neurophysiol, vol. 8, n. 3, agosto 1956, pp. 385-402, PMID 13330651.
- ^ KE. Webster, IM. Colrain, Multichannel EEG analysis of respiratory evoked-potential components during wakefulness and NREM sleep., in J Appl Physiol, vol. 85, n. 5, novembre 1998, pp. 1727-35, PMID 9804575.
- ^ L. McCormick, T. Nielsen; A. Nicolas; M. Ptito; J. Montplaisir, Topographical distribution of spindles and K-complexes in normal subjects., in Sleep, vol. 20, n. 11, novembre 1997, pp. 939-41, PMID 9456457.
- ^ S. Happe, P. Anderer; G. Gruber; G. Klösch; B. Saletu; J. Zeitlhofer, Scalp topography of the spontaneous K-complex and of delta-waves in human sleep., in Brain Topogr, vol. 15, n. 1, 2002, pp. 43-9, PMID 12371676.
- ^ F. Amzica, M. Steriade, Cellular substrates and laminar profile of sleep K-complex., in Neuroscience, vol. 82, n. 3, febbraio 1998, pp. 671-86, PMID 9483527.
- ^ P. Halász, K-complex, a reactive EEG graphoelement of NREM sleep: an old chap in a new garment., in Sleep Med Rev, vol. 9, n. 5, ottobre 2005, pp. 391-412, DOI:10.1016/j.smrv.2005.04.003, PMID 16122950.
- ^ a b JJ. Eady, JH. Peacock; TJ. McMillan, Host cell reactivation of gamma-irradiated adenovirus 5 in human cell lines of varying radiosensitivity., in Br J Cancer, vol. 66, n. 1, luglio 1992, pp. 113-8, PMID 1637659.
- ^ a b A. Wauquier, Aging and changes in phasic events during sleep., in Physiol Behav, vol. 54, n. 4, Ott 1993, pp. 803-6, PMID 8248360.
- ^ (EN) Luigi De Gennaro, Maurizio Gorgoni e Flaminia Reda, The Fall of Sleep K-Complex in Alzheimer Disease, in Scientific Reports, vol. 7, n. 1, 2017-05, pp. 39688, DOI:10.1038/srep39688. URL consultato il 21 dicembre 2022.
- ^ (EN) Brendan P. Lucey, The K-complexes they are a-changin’, in Science Translational Medicine, vol. 9, n. 374, 25 gennaio 2017, pp. eaal4998, DOI:10.1126/scitranslmed.aal4998. URL consultato il 21 dicembre 2022.
- ^ (EN) Alex Iranzo, Joan Santamaria e Eduardo Tolosa, Idiopathic rapid eye movement sleep behaviour disorder: diagnosis, management, and the need for neuroprotective interventions, in The Lancet Neurology, vol. 15, n. 4, 2016-04, pp. 405–419, DOI:10.1016/S1474-4422(16)00057-0. URL consultato il 21 dicembre 2022.
- ^ (EN) Andrea Galbiati, Giulia Carli e Elisabetta Fasiello, Exploring the functional role and neural correlates of K-complexes in isolated rapid eye movement sleep behavior disorder, in Cortex, vol. 145, 2021-12, pp. 105–114, DOI:10.1016/j.cortex.2021.08.012. URL consultato il 21 dicembre 2022.
- ^ M. Steriade, F. Amzica, Slow sleep oscillation, rhythmic K-complexes, and their paroxysmal developments., in J Sleep Res, 7 Suppl 1, 1998, pp. 30-5, PMID 9682191.
- ^ J. El Helou, V. Navarro; C. Depienne; E. Fedirko; E. LeGuern; M. Baulac; I. An-Gourfinkel; C. Adam, K-complex-induced seizures in autosomal dominant nocturnal frontal lobe epilepsy., in Clin Neurophysiol, vol. 119, n. 10, Ott 2008, pp. 2201-4, DOI:10.1016/j.clinph.2008.07.212, PMID 18762450.
- ^ J. Montplaisir, S. Boucher; A. Gosselin; G. Poirier; G. Lavigne, Persistence of repetitive EEG arousals (K-alpha complexes) in RLS patients treated with L-DOPA., in Sleep, vol. 19, n. 3, aprile 1996, pp. 196-9, PMID 8723375.
- ^ J. Huang, IM. Colrain; MC. Melendres; LR. Karamessinis; ME. Pepe; JM. Samuel; RF. Abi-Raad; WH. Trescher; CL. Marcus, Cortical processing of respiratory afferent stimuli during sleep in children with the obstructive sleep apnea syndrome., in Sleep, vol. 31, n. 3, marzo 2008, pp. 403-10, PMID 18363317.
- ^ J. Gora, J. Trinder; R. Pierce; IM. Colrain, Evidence of a sleep-specific blunted cortical response to inspiratory occlusions in mild obstructive sleep apnea syndrome., in Am J Respir Crit Care Med, vol. 166, n. 9, novembre 2002, pp. 1225-34, DOI:10.1164/rccm.2106005, PMID 12403692.
- ^ L. Afifi, C. Guilleminault; IM. Colrain, Sleep and respiratory stimulus specific dampening of cortical responsiveness in OSAS., in Respir Physiol Neurobiol, vol. 136, n. 2-3, luglio 2003, pp. 221-34, PMID 12853013.
Voci correlate[modifica | modifica wikitesto]
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) K-complex, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.