Bedaquilina
| Bedaquilina | |
|---|---|
 | |
| Nome IUPAC | |
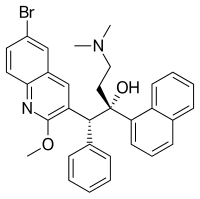
| (1R,2S)-1-(6-Bromo-2-methoxy-3-quinolyl)-4-dimethylamino-2-(1-naphthyl)-1-phenylbutan-2-ol | |
| Nomi alternativi | |
| Sirturo (nome commerciale),
(alphaS,betaR)-6-Bromo-alpha-[2-(dimethylamino)ethyl]-2-methoxy-alpha-1-naphthalenyl-beta-phenyl-3-quinolineethanol | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C32H31BrN2O2 |
| Aspetto | polvere bianca |
| Numero CAS | |
| Codice ATC | J04 |
| PubChem | 5388906 |
| DrugBank | DB08903 |
| SMILES | Brc1ccc2nc(OC)c(cc2c1)[C@@H](c3ccccc3)[C@](O)(c5c4ccccc4ccc5)CCN(C)C |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a {{{Ka_temperatura}}} K | 13.61 |
| Solubilità in acqua | 1.77x10-3 mg/L a 25 °C |
| Dati farmacologici | |
| Categoria farmacoterapeutica | Antibiotici |
| Teratogenicità | non nota |
| Modalità di somministrazione | orale |
| Dati farmacocinetici | |
| Biodisponibilità | 94-108%[1] |
| Legame proteico | >99.9%[2] |
| Metabolismo | epatico, citocromo CYP3A4 |
| Emivita | 5.5 mesi[3] |
| Escrezione | fecale |
| Indicazioni di sicurezza | |
La Bedaquilina è un antimicobatterico della classe delle diarylquinoline. Le diarylquinoline (DARQs) sono un gruppo di farmaci battericidi, che inibiscono l’enzima ATP sintetasi dei micobatteri legandosi alla subunità c[4]. Sebbene l’ATP sintetasi batterico è simile a quelli degli eucarioti, le diarylquinoline sono molto specifiche per l’enzima batterico, per cui il loro uso è considerato sicuro nell’uomo[5]. Negli ultimi anni la ricerca ha portato all’introduzione di tre nuovi farmaci antitubercolari: la bedaquilina, il delamanid e il pretomanid[6]. La comparsa di ceppi multiresistenti di Mycobacterium tuberculosis ha stimolato la ricerca di nuovi farmaci[7].
Storia[modifica | modifica wikitesto]
La Bedaquilina è stata descritta per la prima volta nel 2004 Interscience Conference on Antimicrobial Agents and Chemotherapy dell’American Society for Microbiology dopo sette anni di ricerche[8][9]. La molecola fu scoperta dal gruppo di Koen Andries presso la Janssen Pharmaceutica[10]. Il farmaco è prodotto dalla Johnson & Johnson[11]. Al momento dell'approvazione da parte dell’FDA, il 28 dicembre 2012, era il primo nuovo farmaco per la tubercolosi in più di quaranta anni[12][13], nonostante la comparsa della tubercolosi multifarmaco resistente associata a intolleranza ai farmaci di prima linea[14]. Il trattamento farmacologico standard della tubercolosi attiva ha tradizionalmente una durata di sei mesi. In genere è consigliata l’assunzione di 4 farmaci di prima linea come isoniazide, rifampicina, pirazinamide, etambutolo. Se il trattamento è incompleto o non correttamente somministrato porta molto frequentemente all’insorgenza di ceppi resistenti. La tubercolosi multifarmaco-resistente (MDR-TB, multidrug-resistant pulmonary tubercolosis), di solito dovuta alla presenza di ceppi resistenti a isoniazide e rifampicina, presenta un rischio di mortalità molto più alto rispetto alla tubercolosi farmaco-sensibile. Secondo l’OMS, la MDR-TB è presente in ogni area del mondo. L’OMS ha pubblicato nel 2020 un manuale operativo che riassume le ultime linee guida consolidate sulla terapia della tubercolosi rifampicina o isoniazide o multifarmaco resistente[15]. La bedaquilina è stata approvata per uso medico negli Stati Uniti nel 2012[16]. Ha ricevuto l’Autorizzazione all’Immissione in Commercio (AIC) in Europa e in Italia da parte dell’European Medicines Agency (EMA) e dell’AIFA[17] con procedura centralizzata condizionata[18], con l’indicazione per il trattamento, in associazione ad altri farmaci, di pazienti adulti con tubercolosi polmonare multifarmaco-resistente, in caso di problemi di tollerabilità o resistenza ad altri regimi terapeutici. L’EMA ha classificato la bedaquilina tra i farmaci orfani, poiché in Unione Europea la tubercolosi è considerata rara.[19] È presente nel listino dei medicinali essenziali dell'Organizzazione mondiale della sanità[20]. Il nome commerciale è Sirturo®, confezione da 188 cpr per uso orale da 100 mg. In Italia è sottoposto a monitoraggio addizionale. È in classe di rimborsabilità H. La prescrizione è limitata ai centri ospedalieri o specialistici da parte di Infettivologi e Pneumologi.
Meccanismo di azione[modifica | modifica wikitesto]
La Bedaquilina è la prima molecola del nuovo gruppo di farmaci detti Diaylquinoline. Inibisce la pompa protonica della ATP sintetasi[21]. L’enzima è essenziale per la produzione di energia dei micobatteri, la sua inibizione impedisce l’accrescimento batterico dopo alcune ore dall’aggiunta del farmaco. La parte specifica dell’ATP sintetasi colpita dalla bedaquilina è l’unità c, codificata dal gene atpE. Mutazioni di questo gene possono portare a resistenza[22]. In vitro il farmaco è altamente efficace contro ceppi di M. tubercolisi farmaco-resistenti o farmaco-sensibili. L’inizio dell’effetto battericida nell’uomo inizia dopo numerosi giorni di trattamento, per poi proseguire in modo continuativo. In pazienti affetti da tubercolosi farmaco-sensibile mai trattati in precedenza, l’attività battericida della bedaquilina, somministrata in monoterapia per 7 giorni, è stata simile a quella dell’isoniazide o della rifampicina. Non è stata riscontrata resistenza crociata con altri farmaci antitubercolari[23].
Farmacocinetica[modifica | modifica wikitesto]
Le concentrazioni plasmatiche massime di bedaquilina vengono raggiunte circa 5 ore dopo la somministrazione orale. Il cibo ne aumenta la biodisponibilità di circa due volte, per cui è raccomandata l’assunzione con il cibo. Il legame alle proteine plasmatiche è maggiore del 99%. Dopo aver raggiunto la Cmax, le concentrazioni di bedaquilina diminuisce in modo tri-esponenziale. Il volume di distribuzione è di 164 L La molecola è metabolizzata principalmente a livello epatico dal citocromo CYP3A4 con la formazione di un metabolita attivo N-monodesmetile (M2). L’M2 è circa 4-6 volte meno efficace della molecola somministrata. Entrambe vengono eliminati con le feci (l’escrezione renale è molto bassa, inferiore allo 0,001%). Una successiva demetilazione porta alla formazione di M3, ossidazione e epossidazione. Oltre all’M2 e all’M3 sono stati identificati inoltre un derivato idrossilato (M2O) e un derivato diidrodiolo (M11). L’emivita di eliminazione terminale media della bedaquilina e del suo metabolita attivo M2 è di circa 5 mesi (2-8 mesi) a causa del lento rilascio dai tessuti periferici[24]. Una emivita così lunga può causare l’insorgenza di reazioni avverse e di interazioni a distanza di tempo dall’assunzione dell’ultima dose di farmaco[25].
Interazioni[modifica | modifica wikitesto]
La contemporanea somministrazione della bedaquilina con forti induttori del CYP3A4 (es. rifampicina) può diminuirne le concentrazioni plasmatiche e ridurne l’effetto antibatterico. Ad esempio la co-somministrazione della rifampicina porta alla diminuzione del 52% dell’AUC (area sotto la curva di concentrazione) del farmaco[26]. I farmaci forti inibitori del CYP3A4 (es. ketoconazolo) non dovrebbero essere somministrati insieme alla bedaquilina perché possono aumentarne le concentrazioni sieriche e il rischio di reazioni avverse. L’impiego di bedaquilina con altri farmaci che prolungano l’intervallo QT (es. i Fluorochinoloni) può avere un effetto additivo sul prolungamento dell’intervallo QT[27] Alcuni farmaci antiretrovirali utilizzati in pazienti con AIDS come il Lopinavir e il Ritonavir aumentano la concentrazione della bedaquilina. Anche altri antiretrovirali inibiscono o inducono il CYP3A4[28]
Effetti collaterali[modifica | modifica wikitesto]
I più comuni effetti collaterali della Bedaquilina nausea, vomito, diarrea, mialgia, artralgia, cefalea, capogiri, prolungamento dell'intervallo QT all’elettrocardiogramma, aumento delle transaminasi[29]. Prima dell’inizio del trattamento ed almeno una volta al mese durante la terapia deve essere eseguito un elettrocardiogramma dopo l’inizio del trattamento con bedaquilina Devono essere controllati i livelli basali di potassiemia, calcemia e magnesemia. Se il QT supera i 500 ms il trattamento deve essere sospeso (0,6% dei casi)[30]. Non è stata dimostrata la comparsa di torsioni di punta durante la terapia. In alcuni studi eseguiti nella fase II è stata segnalata una maggiore mortalità tra i gruppi di pazienti trattati con bedaquilina rispetto ai non trattati. Questo aumento di mortalità non è stato completamente chiarito[31][32]. Questo ha portato a una importante controversia durante l’approvazione del farmaco; data l’esistenza tuttora di significativa preoccupazione per questa più alta mortalità la Bedaquilina viene raccomandato di limitare l’uso della Bedaquilina ai casi in cui non può essere impostato in altro modo un regime a quattro farmaci e di limitare l’uso di altri farmaci che allungano il QT in associazione[33].
Modalità di somministrazione[modifica | modifica wikitesto]
La bedaquilina dovrebbe essere somministrata per 24 settimane in associazione con almeno 3 medicinali ai quali l’isolato del paziente si sia dimostrato sensibile in vitro. Se non sono disponibili risultati di test in vitro, il trattamento con bedaquilina può essere iniziato in associazione con almeno 4 medicinali ai quali l’isolato del paziente è probabilmente sensibile. Le compresse devono essere assunte a stomaco pieno, in quanto il cibo ne aumenta la biodisponibilità orale di circa due volte, e deglutite intere con acqua. Dopo il completamento del trattamento con bedaquilina, il trattamento con gli altri medicinali del regime di associazione deve essere continuato[34][35].
Dosaggio[modifica | modifica wikitesto]
Nell’adulto dai 18 anni in su e negli adolescenti di età compresa tra 12 e 18 anni e di peso di almeno 30 Kg il dosaggio raccomandato è di 100 mg tre volte la settimana con almeno 48 ore di intervallo tra le dosi. Uno schema terapeutico alternativo prevede la somministrazione di una dose di carico di 400 mg una volta al giorno per due settimane, seguito da 200 mg tre volte la settimana per 22 settimane. Sono state provate delle simulazioni farmacocinetiche per esplorare altri regimi terapeutici più semplici, che sono ancora sotto valutazione clinica, ad esempio 200 mg una volta al giorno per 8 settimane seguito da 100 mg una volta al giorno[36]. La durata del trattamento è comunque di 24 settimane. I dati su una durata superiore sono molto limitati; può essere presa in considerazione caso per caso con un controllo attento della sicurezza nei pazienti con estesa farmacoresistenza[37].
Costo[modifica | modifica wikitesto]
In Italia il costo della confezione di Bedaquilina è di 33.109,50 € (al 21-10-2020) La bedaquilina, classificata dalla Commissione Tecnico Scientifica dell’AIFA come farmaco potenzialmente innovativo, è stata inserita nell’elenco dei farmaci sotto monitoraggio addizionale AIFA ed è obbligatoria la compilazione della relativa scheda di monitoraggio[37]. L’elevato costo dei nuovi farmaci antitubercolari è particolarmente problematico soprattutto nei paesi del terzo mondo, dove sono maggiormente diffusi i ceppi resistenti di mycobatteri[38].
Note[modifica | modifica wikitesto]
- ^ https://www.researchgate.net/publication/326036735_Relative_bioavailability_of_bedaquiline_tablets_suspended_in_water_Implications_for_dosing_in_children
- ^ Sirturo: Clinical Pharmacology, su rxlist.com. URL consultato il 28 aprile 2014 (archiviato dall'url originale il 28 febbraio 2015).
- ^ Bedaquiline, su imnotebook.com. URL consultato il 28 aprile 2014 (archiviato dall'url originale il 20 maggio 2013).
- ^ Anil Koul, Najoua Dendouga, Karen Vergauwen, Brenda Molenberghs, Luc Vranckx, Rudy Willebrords, Zorica Ristic, Holger Lill, Ismet Dorange, Jerome Guillemont, Dirk Bald e Koen Andries, Diarylquinolines target subunit c of mycobacterial ATP synthase, in Nature Chemical Biology, vol. 3, n. 6, 2007, pp. 323-324, DOI:10.1038/nchembio884, ISSN 1552-4450, PMID 17496888.
- ^ A. C. Haagsma, R. Abdillahi-Ibrahim, M. J. Wagner, K. Krab, K. Vergauwen, J. Guillemont, K. Andries, H. Lill, A. Koul e D. Bald, Selectivity of TMC207 towards Mycobacterial ATP Synthase Compared with That towards the Eukaryotic Homologue (PDF), in Antimicrobial Agents and Chemotherapy, vol. 53, n. 3, 2008, pp. 1290-2, DOI:10.1128/AAC.01393-08, PMC 2650532, PMID 19075053.
- ^ Keam SJ, Pretomanid: First Approval., in Drugs, vol. 79, n. 16, 2019, pp. 1797-1803, DOI:10.1007/s40265-019-01207-9, PMID 31583606.
- ^ Dheda K, Gumbo T, Maartens G, Dooley KE, McNerney R, Murray M, The epidemiology, pathogenesis, transmission, diagnosis, and management of multidrug-resistant, extensively drug-resistant, and incurable tuberculosis., in Lancet Respir Med, 2017, DOI:10.1016/S2213-2600(17)30079-6, PMID 28344011.
- ^ Protopopova M, Bogatcheva E, Nikonenko B, Hundert S, Einck L, Nacy CA, In search of new cures for tuberculosis (PDF), in Medicinal Chemistry, vol. 3, n. 3, maggio 2007, pp. 301-16, DOI:10.2174/157340607780620626, PMID 17504204. URL consultato il 21 gennaio 2021 (archiviato dall'url originale il 3 luglio 2020).
- ^ Formula 3D, su chemapps.stolaf.edu.
- ^ de Jonge MR, Koymans LH, Guillemont JE, Koul A, Andries K, A computational model of the inhibition of Mycobacterium tuberculosis ATPase by a new drug candidate R207910, in Proteins, vol. 67, n. 4, giugno 2007, pp. 971-80, DOI:10.1002/prot.21376, PMID 17387738.
- ^ Joseph Walker e Nathalie Tadena, J&J Tuberculosis Drug Gets Fast-Track Clearance, su Wall Street Journal, 31 dicembre 2012. URL consultato il 21 gennaio 2021.
- ^ U.S. FDA approves first new tuberculosis drug in 40 years, su ctvnews.ca. URL consultato il 21 gennaio 2021.
- ^ F.D.A. Approves New Tuberculosis Drug, su The New York Times, 31 dicembre 2012. URL consultato il 21 gennaio 2021.
- ^ Conradie F, Diacon AH, Ngubane N, Howell P, Everitt D, Crook AM, Treatment of Highly Drug-Resistant Pulmonary Tuberculosis., in N Engl J Med, vol. 382, n. 10, 2020, pp. 893-902, DOI:10.1056/NEJMoa1901814, PMC 6955640, PMID 32130813.
- ^ WHO Operational Handbook on Tuberculosis, Module 4: Treatment - Drug-Resistant Tuberculosis Treatment, su who.int, 15 giugno 2020. URL consultato il 14 gennaio 2021.
- ^ Bedaquiline Fumarate, su drugs.com, The American Society of Health-System Pharmacists. URL consultato l'8 dicembre 2016 (archiviato dall'url originale il 20 dicembre 2016).
- ^ Pubblicazione sulla Gazzetta Ufficiale, su gazzettaufficiale.it.
- ^ Approvazione condizionata indica la richiesta all’azienda produttrice di conduzione di studi aggiuntivi di follow-up sull’efficienza del farmaco a lungo termine; ogni anno l'EMA controlla ogni nuova informazione disponibile e, se necessario, aggiorna le caratteristiche del farmaco.
- ^ EMA: farmaci orfani, su ema.europa.eu.
- ^ ((World Health Organization)), World Health Organization model list of essential medicines: 21st list 2019, Geneva, World Health Organization, 2019, WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Worley MV, Estrada SJ, Bedaquiline: a novel antitubercular agent for the treatment of multidrug-resistant tuberculosis, in Pharmacotherapy, vol. 34, n. 11, novembre 2014, pp. 1187-97, DOI:10.1002/phar.1482, PMC 5028565, PMID 25203970.
- ^ Andries K, Villellas C, Coeck N, Thys K, Gevers T, Vranckx L, Lounis N, de Jong BC, Koul A, Acquired resistance of Mycobacterium tuberculosis to bedaquiline, in PLOS ONE, vol. 9, n. 7, 10 luglio 2014, pp. e102135, Bibcode:2014PLoSO...9j2135A, DOI:10.1371/journal.pone.0102135, PMC 4092087, PMID 25010492.
- ^ Koul A, Vranckx L, Dhar N, Göhlmann HW, Özdemir E, Neefs JM, Schulz M, Lu P, Mørtz E, McKinney JD, Andries K, Bald D, Delayed bactericidal response of Mycobacterium tuberculosis to bedaquiline involves remodelling of bacterial metabolism, in Nature Communications, vol. 5, n. 1, febbraio 2014, p. 3369, Bibcode:2014NatCo...5.3369K, DOI:10.1038/ncomms4369, PMC 3948051, PMID 24569628.
- ^ Bedaquilina, su informazionisuifarmaci.it. URL consultato il 14 gennaio 2021.
- ^ (EN) Elin Svensson et al., Relative bioavailability of bedaquiline tablets suspended in water: Implications for dosing in children, in Br J Clin Pharmacol., vol. 84, n. 10, ottobre 2018, pp. 2384-2392, DOI:10.1111/bcp.13696. URL consultato il 14 gennaio 2021 (archiviato dall'url originale il 20 gennaio 2022).
- ^ Healan AM, Griffiss JM, Proskin HM, O'Riordan MA, Gray WA, Salata RA, Impact of Rifabutin or Rifampin on Bedaquiline Safety, Tolerability, and Pharmacokinetics Assessed in a Randomized Clinical Trial with Healthy Adult Volunteers., in Antimicrob Agents Chemother, vol. 62, n. 1, 2018, DOI:10.1128/AAC.00855-17, PMC 5740348, PMID 29061739.
- ^ (EN) Prescribing Information for Bedaquiline (PDF), su accessdata.fda.gov. URL consultato il 28 aprile 2014 (archiviato il 24 agosto 2013).
- ^ Pandie M, Wiesner L, McIlleron H, Hughes J, Siwendu S, Conradie F, Drug-drug interactions between bedaquiline and the antiretrovirals lopinavir/ritonavir and nevirapine in HIV-infected patients with drug-resistant TB., in J Antimicrob Chemother, vol. 71, n. 4, 2016, pp. 1037-40, DOI:10.1093/jac/dkv447, PMID 26747099.
- ^ torrinomedica.it, https://www.torrinomedica.it/schede-farmaci/sirturo_100_mg_compressa_uso_oralefl_hdpe_188_cp/#SP8. URL consultato il 20 gennaio 2021.
- ^ Emanuele Pontali, Giovanni Sotgiu, Simon Tiberi, Lia D'Ambrosio, Rosella Centis e Giovanni B. Migliori, Cardiac safety of bedaquiline: a systematic and critical analysis of the evidence, in European Respiratory Journal, vol. 50, n. 5, 2017, p. 1701462, DOI:10.1183/13993003.01462-2017, ISSN 0903-1936.
- ^ Edward Cox e Katherine Laessig, FDA Approval of Bedaquiline — The Benefit–Risk Balance for Drug-Resistant Tuberculosis, in New England Journal of Medicine, vol. 371, n. 8, 2014, pp. 689-691, DOI:10.1056/NEJMp1314385, ISSN 0028-4793.
- ^ Andreas H. Diacon, Alexander Pym, Martin P. Grobusch, Jorge M. de los Rios, Eduardo Gotuzzo, Irina Vasilyeva, Vaira Leimane, Koen Andries, Nyasha Bakare, Tine De Marez, Myriam Haxaire-Theeuwes, Nacer Lounis, Paul Meyvisch, Els De Paepe, Rolf P.G. van Heeswijk e Brian Dannemann, Multidrug-Resistant Tuberculosis and Culture Conversion with Bedaquiline, in New England Journal of Medicine, vol. 371, n. 8, 2014, pp. 723-732, DOI:10.1056/NEJMoa1313865, ISSN 0028-4793.
- ^ Karen Cohen e Gary Maartens, A safety evaluation of bedaquiline for the treatment of multi-drug resistant tuberculosis, in Expert Opinion on Drug Safety, vol. 18, n. 10, 2019, pp. 875-882, DOI:10.1080/14740338.2019.1648429, ISSN 1474-0338.
- ^ AIFA: Informazioni sui Farmaci, su informazionisuifarmaci.it. URL consultato il 15 gennaio 2021.
- ^ (EN) EMA: Sirturo, su ema.europa.eu. URL consultato il 15 gennaio 2021.
- ^ Salinger DH, Nedelman JR, Mendel C, Spigelman M, Hermann DJ, Daily Dosing for Bedaquiline in Patients with Tuberculosis., in Antimicrob Agents Chemother, vol. 63, n. 11, 2019, DOI:10.1128/AAC.00463-19, PMC 6811417, PMID 31451504.
- ^ a b Scheda farmaco Torrinomedica, su torrinomedica.it. URL consultato il 15 gennaio 2021.
- ^ (EN) Farmaci per la prevenzione della tbc, su msfaccess.org. URL consultato il 14 gennaio 2021.
Bibliografia[modifica | modifica wikitesto]
- Louis Goodman, Le basi farmacologiche della terapia, Bologna, Zanichelli, 2019, ISBN 978-88-08-82056-3, OCLC 1137115858.
- Burke Cunha, Antibiotic essentials, New Delhi, India, Jaypee Brothers Medical Publishers, 2015, ISBN 978-93-89776-31-7, OCLC 973210763.
- Mauro Moroni, Manuale di malattie infettive, Milano, Edra, 2020, ISBN 978-88-214-5111-9, OCLC 1155706851.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su bedaquilina
Wikimedia Commons contiene immagini o altri file su bedaquilina