Anticorpo a dominio singolo
Un anticorpo a dominio singolo (sdAb), noto anche come nanocorpo (o in iglese nanobody), è un frammento di anticorpo costituito da un singolo dominio di anticorpo monomerico variabile. Come un intero anticorpo, è in grado di legarsi selettivamente a uno specifico antigene. Con un peso molecolare di soli 12-15 kDa, gli anticorpi a dominio singolo sono molto più piccoli degli anticorpi comuni (150-160 kDa) che sono composti da due catene proteiche pesanti e due catene leggere, e anche più piccoli dei frammenti Fab (~ 50 kDa, una catena leggera e mezza catena pesante) e frammenti variabili a catena singola(~ 25 kDa, due domini variabili, uno da una catena leggera e uno da una catena pesante).[1]
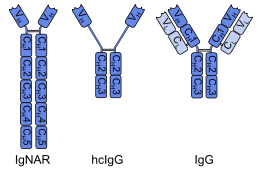
I primi anticorpi a dominio singolo sono stati trovati partendo da anticorpi a catena pesante trovati nei camelidi; questi sono chiamati VH frammenti H. I pesci cartilaginei hanno anche anticorpi a catena pesante (IgNAR, "nuovo recettore dell'antigene dell'immunoglobulina"), da cui è possibile ottenere anticorpi a dominio singolo chiamati frammenti VNAR.[2]
Un approccio alternativo consiste nello scindere i domini delle variabili dimeriche dalle comuni immunoglobuline G (IgG) da esseri umani o topi in monomeri. Sebbene la maggior parte della ricerca sugli anticorpi a dominio singolo sia attualmente basata su domini variabili della catena pesante, è stato anche dimostrato che i nanobodies derivati dalle catene leggere si legano specificamente agli epitopi bersaglio.[3]
È stato dimostrato che gli anticorpi dei camelidi a dominio singolo sono specifici quanto un normale anticorpo e in alcuni casi sono più robusti. Inoltre, sono facilmente isolati utilizzando la stessa procedura di panning dei fagi utilizzata per gli anticorpi tradizionali, consentendo loro di essere coltivati in vitro in grandi concentrazioni. Le dimensioni ridotte e il dominio singolo rendono questi anticorpi più facili da trasformare in cellule batteriche per la produzione di massa, rendendoli ideali per scopi di ricerca.[4]
Gli anticorpi a dominio singolo sono oggetto di ricerca per molteplici applicazioni farmaceutiche e hanno un potenziale per l'uso nel trattamento della sindrome coronarica acuta, cancro della malattia di Alzheimer.[5][6]
Note[modifica | modifica wikitesto]
- ^ Harmsen MM, De Haard HJ, Properties, production, and applications of camelid single-domain antibody fragments, in Appl. Microbiol. Biotechnol., vol. 77, n. 1, November 2007, pp. 13–22, DOI:10.1007/s00253-007-1142-2, PMC 2039825, PMID 17704915.
- ^ English H, Hong J, Ho M, Ancient species offers contemporary therapeutics: an update on shark VNAR single domain antibody sequences, phage libraries and potential clinical applications, in Antib Ther, vol. 3, n. 1, January 2020, pp. 1–9, DOI:10.1093/abt/tbaa001, PMID 32118195.
- ^ Möller A, Pion E, Narayan V, Ball KL, Intracellular activation of interferon regulatory factor-1 by nanobodies to the multifunctional (Mf1) domain, in J. Biol. Chem., vol. 285, n. 49, December 2010, pp. 38348–61, DOI:10.1074/jbc.M110.149476, PMC 2992268, PMID 20817723.
- ^ Ghannam A, Kumari S, Muyldermans S, Abbady AQ, Camelid nanobodies with high affinity for broad bean mottle virus: a possible promising tool to immunomodulate plant resistance against viruses, in Plant Mol. Biol., vol. 87, n. 4-5, March 2015, pp. 355–69, DOI:10.1007/s11103-015-0282-5, PMID 25648551.
- ^ Nanobodies herald a new era in cancer therapy, The Medical News, 12 maggio 2004.
- ^ Pipeline, su ablynx.com, Ablynx. URL consultato il 20 gennaio 2010 (archiviato dall'url originale il 4 gennaio 2010).
Collegamenti esterni[modifica | modifica wikitesto]
- Anticorpi: struttura, sintesi, classificazione e funzioni, su Biopills.net
- Applicazioni di Nanobody, su news-medical.net (archiviato dall'url originale il 23 settembre 2020).
- Sviluppo di Nanobody, su news-medical.net (archiviato dall'url originale il 1º agosto 2021).
- (EN) Recombinant expression of nanobodies and nanobody-derived immunoreagents, su ncbi.nlm.nih.gov.