Amminazione riduttiva
Amminazione riduttiva (conosciuta anche come alchilazione riduttiva) è una forma di amminazione che porta alla conversione di un gruppo carbonilico ad un gruppo amminico attraverso la formazione di un'immina intermedia. Il composto contenente il gruppo carbonilico è solitamente un chetone o un'aldeide.
Processo di reazione[modifica | modifica wikitesto]
In questa reazione organica, l'ammina reagisce col composto carbonilico, spesso attivato mediante catalisi acida, per formare un emiamminale, il quale sequenzialmente perde una molecola di acqua in modo reversibile, attraverso una alchilimmino-de-osso-bisostituzione, per formare l'immina. L'equilibrio aldeide/chetone ed immina può essere spostato verso l'immina allontanando l'acqua formatasi. L'immina può essere isolata e ridotta ad ammina con un opportuno agente riducente (come il boroidruro di sodio o l'idruro di litio ed alluminio). Questa è un'amminazione riduttiva indiretta.
L'amminazione riduttiva diretta, invece, può essere eseguita con simultanea formazione dell'immina e sua riduzione. Tale reazione si ottiene con agenti riducenti che sono più reattivi verso le immine protonate dei chetoni, e che sono stabili in condizioni moderatamente acide. Tra questi riducenti vi sono ad esempio il cianoboroidruro di sodio (NaBH3CN) e il sodio triacetossiboroidruro (NaBH(OCOCH3)3).[1] In anni recenti questa reazione è stata condotta in ambiente acquoso gettando dubbi sulla necessità di formare l'immina.[2] La ragione è che la perdita della molecola d'acqua termodinamicamente è sfavorita dalla presenza di una grande quantità di acqua nel suo ambiente, come si vede nel lavoro di Turner et al.[3] Pertanto, questo suggerisce che in alcuni casi la reazione procede per riduzione diretta delle specie emiamminali.[4]
Variazioni e reazioni collegate[modifica | modifica wikitesto]
Questo processo è legato alla reazione di Eschweiler-Clarke, nella quale le ammine sono metilate in ammine terziarie, alla reazione di Leuckart-Wallach con acido formico e ad altri metodi di alchilazione delle ammine come la reazione di Mannich e la reazione di Petasis.
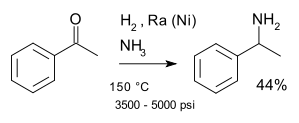
Una classica reazione che prende il nome dal suo scopritore è la reazione di Mignonac (1921)[5] che implica la reazione di un chetone con l'ammoniaca su un catalizzatore al nichel, per esempio in una sintesi di 1-feniletilammina a partire dall'acetofenone:[6]
Nell'industria, le ammine terziarie come la trietilammina e la diisopropiletilammina vengono formate direttamente dai chetoni con una miscela gassosa di ammoniaca e idrogeno e un opportuno catalizzatore.
Biochimica[modifica | modifica wikitesto]
Un passo nella biosintesi di molti α-amminoacidi è l'amminazione riduttiva di un α-chetoacido, solitamente mediante un enzima transaminasi. Il processo è catalizzato dalla piridossamina, che è convertita in piridossalfosfato dopo la reazione. Il passo iniziale comporta la formazione di un'immina, ma gli equivalenti idruri sono forniti da una piridina ridotta per produrre un'aldimmina, che si idrolizza nell'ammina.[7] La sequenza da chetoacido ad amminoacido può essere riassunta come segue:
Note[modifica | modifica wikitesto]
- ^ Ellen W. Baxter e Allen B. Reitz, Reductive Aminations of Carbonyl Compounds with Borohydride and Borane Reducing Agents, Organic Reactions, 1, 59, 2002 (Review[collegamento interrotto])
- ^ Shinya Sato, Takeshi Sakamoto, Etsuko Miyazawa e Yasuo Kikugawa, One-Pot Reductive Amination of Aldehydes and Ketones with α-Picoline Borane in Methanol, in Water, and in Neat Conditions, Tetrahedron, 7899-7906, 60, 2004, DOI: 10.1016/j.tet.2004.06.045
- ^ Colin J. Dunsmore, Reuben Carr, Toni Fleming e Nicholas J. Turner, A Chemo-Enzymatic Route to Enantiomerically Pure Cyclic Tertiary Amines, J Am Chem Soc, 2224-2225, 128(7), 2006
- ^ V. A. Tarasevich e N. G. Kozloz, Reductive Amination of Oxygen-Containing Organic Compounds, Russian Chemical Reviews, 68(1), 55-72, 1999
- ^ Nouvelle méthodegénérale de préparation des amines à partir des aldéhydes ou des cétones. M. Georges Mignonac, Compt. rend., 172, 223 (1921).
- ^ John C. Robinson, Jr. e H. R. Snyder, α-Phenylethylamine, in Org. Synth., Coll. Vol. 3, 1955, p. 717. URL consultato il 26 febbraio 2013 (archiviato dall'url originale il 2 ottobre 2012).
- ^ Nelson, D. L.; Cox, M. M., Lehninger, Principles of Biochemistry, 3rd ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
Voci correlate[modifica | modifica wikitesto]
Collegamenti esterni[modifica | modifica wikitesto]
- Current methods for reductive amination, su organic-chemistry.org.
- Industrial Reductive amination at BASF[collegamento interrotto]