Idrossiprogesterone caproato
| Idrossiprogesterone Caproato | |
|---|---|
 | |
| Nome IUPAC | |
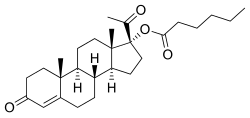
| [(8R,9S,10R,13S,14S,17R)-17-acetil-10,13-dimetil- 3-osso-2,6,7,8,9,11,12,14,15,16-decaidro- 1H-ciclopenta[a]fenantren-17-il] esanoato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C27H40O4 |
| Massa molecolare (u) | 428,6041 |
| Numero CAS | |
| Numero EINECS | 211-138-8 |
| PubChem | 169870 |
| DrugBank | DB06789 e DBDB06789 |
| SMILES | CCCCCC(=O)OC1(CCC2C1(CCC3C2CCC4=CC(=O)CCC34C)C)C(=O)C |
| Indicazioni di sicurezza | |
L'idrossiprogesterone caproato possiede le azioni farmacologiche degli ormoni progestinici.
Il 17a-idrossiprogesterone è di per sé privo di attività progestinica, attività che viene incrementata grazie alla esterificazione in posizione 17a con acidi grassi. L'estere caproato dell'idrossiprogesterone è più potente del progesterone stesso e risulta avere una durata di azione più lunga (7-14 giorni). Il farmaco possiede effetti uterotrofici prolungati ed è in grado di sviluppare lo stroma deciduale dell'utero in maniera analoga a quanto si verifica all'inizio della gravidanza. L'utero aumenta di peso per un incremento della sintesi di acidi nucleici, collagene, glicogeno e lipidi. Le abbondanti secrezioni acquose delle ghiandole endocervicali dell'utero (proprie della stimolazione estrogena) si trasformano, sotto l'azione dell'idrossiprogesterone caproato, in secrezioni scarse e viscide.
L'idrossiprogesterone caproato (quando il valore degli estrogeni endogeni è adeguato) trasforma un endometrio di tipo proliferativo in uno di tipo secretorio. L'epitelio vaginale, sotto l'azione del farmaco, si modifica anche in questo caso in maniera analoga a quanto si verifica all'inizio della gravidanza. L'idrossiprogesterone caproato stimola inoltre la crescita del tessuto alveolare mammario ed inibisce la contrattilità uterina. L'idrossiprogesterone caproato possiede solo deboli effetti androgenici.
L'idrossiprogesterone caproato deve essere conservato in contenitori ben chiusi, al riparo dalla luce e a una temperatura compresa tra 15 e 30 °C. L'idrossiprogesterone caproato per uso iniettivo è una soluzione sterile in un adatto olio vegetale (olio di ricino o di sesamo). Le soluzioni iniettabili oleose vengono sterilizzate con calore secco.
Farmacocinetica[modifica | modifica wikitesto]
Il farmaco, assorbito per il 90% dopo somministrazione orale, subisce un metabolismo presistemico pari al 45-55% della dose. L'emivita plasmatica è di 2-11 ore. Il farmaco si lega alle proteine plasmatiche per l'80-90% e possiede un volume di distribuzione di 5 l/kg.
Viene escreto per via renale e fecale. Il 17a-idrossiprogesterone si trova sulla via metabolica che dal progesterone porta agli ormoni androgeni ed estrogeni. L'idrossilazione del progesterone a livello del C-17 porta alla produzione di 17a-idrossiprogesterone. La catena laterale del C-20 e del C-21 viene spezzata per arrivare all'androstendione, un debole androgeno. Il metabolismo può procedere quindi verso la formazione di testosterone (in seguito alla riduzione del chetogruppo 17 dell'androstendione) o verso la formazione di estrone (per perdita del gruppo metilico e formazione di un anello aromatico). L'assenza dell'enzima 21-idrossilasi aumenta le concentrazioni di 17a-idrossiprogesterone, portando ad un incremento della quantità di androgeni.
Sintesi[modifica | modifica wikitesto]
L'idrossiprogesterone caproato può essere ottenuto attraverso la seguente via sintetica:[1]
Indicazioni terapeutiche[modifica | modifica wikitesto]
Il farmaco è particolarmente indicato nella prevenzione dell'aborto abituale o nel trattamento della minaccia d'aborto. È utilizzato nel parto prematuro per posticipare l'inizio delle contrazioni regolari.
L'idrossiprogesterone caproato può essere usato nella terapia aggiuntiva e palliativa nel trattamento del carcinoma metastatico inoperabile dell'endometrio.
Vie di somministrazione[modifica | modifica wikitesto]
L'idrossiprogesterone caproato viene somministrato per iniezione intramuscolare profonda.
Effetti collaterali[modifica | modifica wikitesto]
L'idrossiprogesterone caproato, come gli altri progestinici, può causare metrorragia, disturbi del flusso mestruale, amenorrea, modificazioni delle secrezione cervicale, edema, aumento o perdita ponderale, ittero colestatico, rash di natura allergica con o senza prurito, melasma o cloasma, depressione psichica. In seguito a somministrazione di dosi elevate di farmaco sono stati descritti casi di tosse, dispnea, difficoltà respiratoria.
Il farmaco, quando è assunto in associazione con un estrogeno, può anche provocare tromboflebiti, embolia polmonare, alterazioni della libido, cefalea, vertigini, eretismo, affaticamento, irsutismo, perdita dei capelli, eritema multiforme o nodoso, eruzioni cutanee emorragiche, prurito. La somministrazione per via parenterale può causare dolore e reazioni locali a livello del sito d'iniezione.
Controindicazioni e precauzioni d'uso[modifica | modifica wikitesto]
L'idrossiprogesterone è controindicato in gravidanza (rischio di virilizzazione del feto femmina), durante l'allattamento, in caso di emorragia vaginale non diagnosticata, mancato aborto, carcinoma mammario, tromboflebiti, disordini tromboembolici, depressione psichica. Il farmaco deve essere somministrato con cautela nei pazienti le cui condizioni patologiche potrebbero essere aggravate da una ritenzione di liquidi (es. asma, epilessia, emicrania, disfunzioni renali o cardiache).
Note[modifica | modifica wikitesto]
- ^ H. J. Ringold, Bjarte Löken, G. Rosenkranz, Franz Sondheimer, The Direct Oppenauer Oxidation of Steroidal Formate Esters. A New Synthesis of 17α-Hydroxyprogesterone, in Journal of the American Chemical Society, vol. 78, n. 4, 1956, pp. 816–819, DOI:10.1021/ja01585a030. URL consultato il 20 gennaio 2014.
Bibliografia[modifica | modifica wikitesto]
- R. Osmond Clark, M. Murray, Br. Med. J. 2, 1172, 1963;
- A. Diddle et al., Obstet. Gynec. 2, 63, 1953;
- J. Johnson et al., New Engl. J. Med. 293, 675, 1975;
- A. Kauppila, L. Friberg, Acta Obstet. Gynec. Scand. 101 (suppl.), 59, 1981;
- E. Reifenstein, Gynecol. Oncology 2, 377, 1974;
- J.R. Mann et al., Lancet 2, 580, 1983.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Idrossiprogesterone caproato
Wikimedia Commons contiene immagini o altri file su Idrossiprogesterone caproato