Complesso di Vaska
| Complesso di Vaska | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| (SP-4-1)-carbonilcloro bis(trifenilfosfano)iridio(I) | |
| Nomi alternativi | |
| trans-carbonilclorobis(trifenilfosfina)iridio(I) complesso di Vaska composto di Vaska | |
| Caratteristiche generali | |
| Formula bruta o molecolare | trans-[Ir(CO)Cl(PPh3)2] |
| Massa molecolare (u) | 780,25 |
| Aspetto | solido cristallino giallo chiaro |
| Numero CAS | |
| Numero EINECS | 238-941-6 |
| SMILES | C1=CC=C(C=C1)P(C2=CC=CC=C2)(C3=CC=CC=C3)[Ir](C#O)(P(C4=CC=CC=C4)(C5=CC=CC=C5)C6=CC=CC=C6)Cl |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 488 (215 °C) dec. |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 20/21/22 |
| Frasi S | 4-9-20-36/37/39-45-60 |
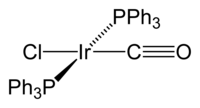
Complesso di Vaska è la denominazione comune del composto chimico con formula trans-[Ir(CO)Cl(PPh3)2]. È un complesso organometallico planare quadrato con uno ione centrale di Ir(I) legato con due leganti trifenilfosfina, un carbonile e uno ione cloruro. La geometria è quella rappresentata in figura, con le due fosfine trans. Il complesso fu descritto per la prima volta da Lauri Vaska e John W. DiLuzio nel 1961.[1] Il complesso di Vaska può dare reazioni di addizione ossidativa, ed è famoso per la sua capacità di legare reversibilmente la molecola di O2. In condizioni normali è un solido cristallino giallo chiaro.
Sintesi[modifica | modifica wikitesto]
La sintesi si effettua riscaldando un qualsiasi sale cloruro di iridio con trifenilfosfina e una sorgente di monossido di carbonio. La procedura più comune usa dimetilformammide (DMF) come solvente, e a volte si aggiunge anilina per accelerare la reazione. Un altro solvente comune è il 2-metossietanolo. La reazione è in genere condotta in atmosfera inerte. La trifenilfosfina agisce sia da legante e sia da riducente; il legante CO si genera per decomposizione della DMF. La reazione è complicata, ma la si può schematizzare con la seguente equazione:[2]
- Ir(H2O)3Cl3 + 3PPh3 + HCON(CH3)2 + PhNH2 →
- [Ir(CO)Cl(PPh3)2] + [(CH3)2NH2]Cl + OPPh3 + [PhNH3]Cl + 2H2O
Come composti di iridio in questa sintesi vengono in genere usati IrCl3•xH2O e H2IrCl6.
Reattività[modifica | modifica wikitesto]
Studi sul complesso di Vaska hanno aiutato a chiarire le basi concettuali della catalisi omogenea e dei meccanismi di trasporto dell'ossigeno in biochimica. Il complesso di Vaska è un composto a 16 elettroni ed è considerato coordinativamente insaturo; può quindi addizionare un legante che dona due elettroni o due leganti che donano un elettrone ciascuno per arrivare alla configurazione satura a 18 elettroni. L'addizione di due leganti monoelettronici è detta addizione ossidativa; a seguito di una reazione di questo tipo lo stato di ossidazione dell'iridio passa da Ir(I) a Ir(III). Contemporaneamente, il reagente inizialmente tetracoordinato planare quadrato diventa esacoordinato, con geometria ottaedrica. Il complesso di Vaska dà reazioni di addizione ossidativa con ossidanti classici come alogeni, acidi forti come HCl, e altre molecole che agiscano come elettrofili, come lo iodiometano (CH3I).
Il complesso di Vaska è stato il primo composto chimico inorganico capace di legare O2 in modo reversibile:[3][4]
- [Ir(CO)Cl(PPh3)2] + O2 ⇄ [Ir(CO)Cl(O2)(PPh3)2]
Il legante diossigeno è legato all'iridio in modo bidentato (side-on in inglese) formando un perosso complesso. Nella mioglobina e nella emoglobina O2 è invece legato in modo monodentato (end-on in inglese) formando un superosso complesso. L'ossigenazione avviene semplicemente facendo gorgogliare ossigeno in una soluzione in toluene del complesso; visivamente si osserva una variazione di colore da giallo ad arancio. L'addotto con ossigeno può essere riconvertito nel complesso iniziale per riscaldamento all'ebollizione in soluzione di benzene, o facendo gorgogliare un gas inerte nella soluzione.
Spettroscopia[modifica | modifica wikitesto]
La spettroscopia infrarossa è molto utile per analizzare i prodotti di addizione ossidativa del complesso di Vaska, dato che queste reazioni provocano variazioni nella frequenza di stiramento del CO coordinato.[5] Queste variazioni dipendono da come cambia la retrodonazione π Ir→C in seguito all'associazione dei nuovi leganti. Esiste una ampia documentazione in letteratura sui valori delle frequenze di stiramento del CO nel complesso di Vaska e nei composti ottenuti per addizione ossidativa di vari leganti.[6] Alcuni valori sono elencati nella tabella seguente:
Composto νCO (cm−1) Complesso di Vaska 1967 Complesso di Vaska + O2 2015 Complesso di Vaska + CH3I 2047 Complesso di Vaska + I2 2067
L'addizione ossidativa per formare specie di Ir(III) riduce la retrodonazione π Ir→C, causando un aumento della frequenza di stiramento del CO. La frequenza osservata dipende dai leganti addizionati, ma in complessi di Ir(III) è sempre maggiore di 2000 cm−1.
Sicurezza[modifica | modifica wikitesto]
Il complesso di Vaska è considerato nocivo per inalazione, contatto con la pelle e ingestione. Non sono noti dati su eventuali proprietà cancerogene.[7]
Note[modifica | modifica wikitesto]
- ^ L. Vaska, J. W. DiLuzio, Carbonyl and hydrido-carbonyl complexes of iridium by reaction with alcohols. Hydrido complexes by reaction with acid, in J. Am. Chem. Soc., vol. 83, n. 12, 1961, pp. 2784–2785, DOI:10.1021/ja01473a054. URL consultato il 9 marzo 2011.
- ^ G. S. Girolami, T. B. Rauchfuss, R. J. Angelici, Synthesis and technique in inorganic chemistry, Mill Valley, CA, University Science Books, 1999, ISBN 0-935702-48-2.
- ^ L. Vaska, Oxygen-carrying properties of a simple synthetic system, in Science, vol. 140, n. 3568, pp. 809-810, DOI:10.1126/science.140.3568.809. URL consultato il 10 marzo 2011.
- ^ A. E. Martell (a cura di), Oxygen complexes and oxygen activation by transition metals, Springer, 1988, ISBN 978-0-306-42789-3.
- ^ L. Vaska, J. W. DiLuzio, Activation of hydrogen by a transition metal complex at normal conditions leading to a stable molecular dihydride, in J. Am. Chem. Soc., vol. 84, n. 4, 1962, pp. 679–680, DOI:10.1021/ja00863a040. URL consultato il 7 marzo 2011.
- ^ R. H. Crabtree, The organometallic chemistry of the transition metals, 5ª ed., Wiley, 2009, ISBN 978-0-470-25762-3.
- ^ Alfa Aesar, Scheda di sicurezza del complesso di Vaska (PDF), su alfa.com. URL consultato il 16 giugno 2021 (archiviato dall'url originale il 13 maggio 2016).
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Complesso di Vaska
Wikimedia Commons contiene immagini o altri file su Complesso di Vaska