Elio
| Elio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | elio, He, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | gas nobili | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 18 (VIIIA), 1, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 0,1785 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica |  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 1S0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 4,002602 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 32 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio di van der Waals | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 1s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 0 (sconosciuto) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | esagonale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | gassoso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 0,95 K (−272,200 °C) a 2,5 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 4,24 K (−268,91 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 21,0×10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 84,5 J/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 5,23 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 970 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 5193 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 0,152 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 24.6 eV (2372 kJ/mol) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 54.4 eV (5251 kJ/mol) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Per approfondire vedi la voce isotopi dell'elio.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'elio (dal greco ἥλιος, hḕlios, "Sole") è l'elemento chimico della tavola periodica che ha numero atomico 2 e simbolo He. È il secondo elemento, dopo l'idrogeno, ed è anche il secondo elemento del blocco s e il secondo e ultimo elemento del primo periodo del sistema periodico.
È un gas nobile incolore, inodore, insapore, non tossico e inerte. Si presenta come gas monoatomico. Dopo l'idrogeno, è l'elemento più leggero e più abbondante nell'universo osservabile,[1] essendo presente in circa il 24% della massa totale elementare, che è più di 12 volte la massa di tutti gli elementi più pesanti insieme: la sua abbondanza è simile a questi dati sia nel Sole sia su Giove; ciò è dovuto all'altissima energia nucleare di legame (per nucleone) di elio-4 (4He) rispetto ai tre elementi successivi all'elio; questa energia di legame spiega anche perché è un prodotto sia della fusione nucleare sia del decadimento radioattivo. La maggior parte dell'elio presente nell'universo è l'elio-4, e si crede che si sia formato durante il Big Bang; grandi quantità di nuovo elio vengono continuamente create dalla fusione nucleare dell'idrogeno che avviene nelle stelle. Prende il nome dal dio greco del Sole, Elio.
È l'elemento con il più basso punto di ebollizione fra tutti gli elementi. Può solidificare solo se sottoposto ad altissime pressioni.
In forma liquida viene utilizzato nella criogenia (il suo maggiore uso singolo, che utilizza circa un quarto della produzione), in particolare nel raffreddamento dei magneti superconduttori, con la principale applicazione commerciale rappresentata dalle apparecchiature per la risonanza magnetica nucleare; altri utilizzi industriali dell'elio sono la pressurizzazione e lo spurgo dei gas, la creazione di un'atmosfera protettiva per la saldatura ad arco e per processi particolari come la crescita di cristalli di silicio; un uso minore è quello di gas di sollevamento per palloni sonda e dirigibili oppure come gas nelle miscele per le immersioni di profondità.[2] Come con qualsiasi gas la cui densità sia diversa da quella dell'aria, inalando un piccolo volume di elio viene, temporaneamente, modificato il timbro e la qualità della voce umana. Nella ricerca scientifica, il comportamento delle due fasi fluide dell'elio-4 (elio I e l'elio II), è importante per i ricercatori che studiano la meccanica quantistica (in particolare la proprietà di superfluidità) e per quelli che sperimentano alcuni fenomeni, come la superconduttività, e i prodotti della materia vicino allo zero assoluto.
Sulla Terra è relativamente raro: 5,2 ppm (parti per milione) in volume nell'atmosfera. La maggior parte dell'elio terrestre presente oggi è stato creato dal decadimento radioattivo naturale degli elementi radioattivi pesanti (torio e uranio, in particolare), in quanto le particelle alfa emesse da tali decadimenti sono composti da nuclei di elio-4. Questo elio radiogenico è intrappolato nel gas naturale in grandi concentrazioni, circa del 7% in volume, da cui viene estratto commercialmente grazie a un processo di separazione a bassa temperatura chiamato distillazione frazionata. In passato, l'elio era ritenuto una risorsa terrestre non rinnovabile poiché una volta rilasciato in atmosfera sfuggiva facilmente nello spazio.[3][4][5] Tuttavia, studi recenti suggeriscono che l'elio prodotto in profondità nella terra dal decadimento radioattivo sia in grado di raccogliersi in riserve di gas naturale in dosi maggiori di quelle attese;[6][7] in alcuni casi può essere rilasciato dall'attività vulcanica.[8]
Storia[modifica | modifica wikitesto]
L'elio fu scoperto dal francese Jules Janssen e dall'inglese Norman Lockyer, indipendentemente l'uno dall'altro, nel 1868. Entrambi stavano studiando la luce solare durante un'eclissi e, analizzandone lo spettro, trovarono la linea di emissione di un elemento sconosciuto. Edward Frankland confermò la scoperta di Janssen e propose che il nome dell'elemento ricordasse Helios, il dio greco del Sole. Nel 1881 Luigi Palmieri annunciò di aver rivelato per la prima volta l'elio sulla Terra dalla sua linea spettrale D3, mentre eseguiva la sublimazione di un prodotto dell'eruzione del Vesuvio.[9] In realtà non portò nell'immediato prove a sostegno della sua tesi e più tardi, dopo che l'elio terrestre fu effettivamente scoperto, vari esperimenti dimostrarono l'impossibilità per Palmieri di aver trovato elio nelle modalità da lui descritte. L'elio dunque venne isolato da Sir William Ramsay nel 1895 dalla cleveite[1] e definitivamente classificato come non metallo. I chimici svedesi Nils Langlet e Per Theodor Cleve, lavorando indipendentemente da Ramsay, riuscirono a isolare l'elio dalla cleveite all'incirca nello stesso periodo.
Nel 1907 Ernest Rutherford e Thomas Royds riuscirono a dimostrare che le particelle alfa sono nuclei di elio. Nel 1908 il fisico olandese Heike Kamerlingh Onnes produsse il primo elio liquido raffreddandolo a 0,9 K, un'impresa che gli valse il Premio Nobel. Nel 1926 un suo studente, Willem Hendrik Keesom, riuscì per primo a solidificare l'elio.
Caratteristiche[modifica | modifica wikitesto]
A temperatura e pressione standard, l'elio esiste solo come gas monoatomico. Condensa solo in condizioni estreme.
Possiede il più basso punto di ebollizione tra tutti gli elementi ed è l'unico liquido che non può essere solidificato abbassandone solo la temperatura; rimane liquido fino allo zero assoluto a pressione standard (si può solidificare solo aumentando la pressione). Infatti la temperatura critica, alla quale non c'è differenza tra lo stato liquido e quello gassoso, è di soli 5,3 K. L'isotopo 3He e l'isotopo 4He solidi sono unici in quanto applicando maggiore pressione, cambiano il loro volume di più del 30%.
L'elio solido esiste solo alla pressione di circa 100 MPa a 15 K; all'incirca a questa temperatura, l'elio subisce una transizione tra le forme ad alta e a bassa temperatura, nelle quali gli atomi strettamente impacchettati assumono rispettivamente una configurazione cubica o esagonale. Tutte queste disposizioni sono simili dal punto di vista energetico e della densità e i motivi della transizione risiedono nel modo in cui gli atomi interagiscono.
L'elio in meccanica quantistica[modifica | modifica wikitesto]

Dal punto di vista della meccanica quantistica, l'elio è il secondo più semplice atomo che può essere modellizzato dopo l'atomo di idrogeno. L'elio è composto da due elettroni in un orbitale atomico attorno a un nucleo contenente due protoni e (di solito) due neutroni. Come in meccanica classica, nessun sistema che consiste di più di due particelle può essere risolto con un approccio matematico analitico esatto (vedi problema dei tre corpi) e l'elio non fa eccezione. Dunque vi è necessità di usare metodi numerici anche per risolvere il sistema di un nucleo e due elettroni. Tale metodo di chimica computazionale è stato utilizzato per descrivere in meccanica quantistica il legame degli elettroni con il nucleo con una accuratezza migliore del 2% del valore misurato sperimentalmente.[10] Tale modello mostra che ogni elettrone scherma parzialmente il nucleo all'altro elettrone, cosicché la carica effettiva Z che ogni elettrone vede, è circa 1,69 e, non 2 e come il nucleo isolato.
Nuclei atomici di elio-4 vengono emessi sotto forma di particella α da elementi radioattivi che seguono quel decadimento. Gli esperimenti di scattering con elettroni di grande energia mostrano che la carica diminuisce esponenzialmente dal massimo al centro, esattamente come fa la densità di carica della nuvola elettronica. Questa simmetria riflette un comportamento fisico simile: la coppia di neutroni e la coppia di protoni del nucleo obbediscono la stessa regola della meccanica quantistica a cui obbediscono la coppia di elettroni (anche se le particelle nucleari sono soggette a energia di legame nucleare molto diversa), di conseguenza tutti questi fermioni occupano un orbitale atomico 1s in coppia, nessuna di queste coppie momento angolare orbitale in quanto cancellano vicendevolmente il loro spin. Aggiungendo un'altra di qualsiasi di queste due particelle richiede momento angolare e sarebbe instabile (infatti non esistono nuclei con nucleoni stabili). Questa configurazione con quattro nucleoni è estremamente stabile da un punto di vista energetico, e questa stabilità spiega molte delle proprietà in natura dell'elio.
Dal punto di vista della nuvola elettronica l'atomo di elio è inerte, cioè non forma molecole stabili. La energia di ionizzazione dell'elio 25,6 eV è la più alta tra gli elementi. La debole interazione tra le nuvole elettroniche degli atomi di elio ha come conseguenza la più piccola temperatura di ebollizione tra tutti gli elementi. Inoltre vi è necessità di una pressione elevata, anche a temperatura prossima allo zero assoluto, per solidificare l'elio a causa della energia di punto zero.
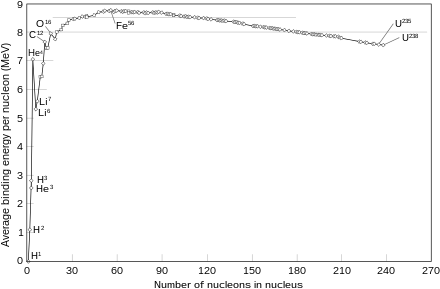
La particolare stabilità del nucleo di elio-4, produce effetti simili, nelle reazioni atomiche in cui sono coinvolti elementi pesanti o avvengono fusioni di nuclei: in genere vengono prodotte particelle alfa. Nella reazione di fusione degli atomi di idrogeno è molto rara la produzione di atomi di elio-3, anche se è un isotopo stabile, la produzione di elio-4 è di gran lunga più probabile.
La inusuale stabilità del nucleo di elio-4 è anche importante in cosmologia: spiega il fatto che nei primi pochi minuti dopo il Big Bang, dal brodo iniziale di protoni e neutroni liberi che è stato inizialmente creati in proporzione 6:1 una volta raffreddati al punto che era possibile formare dei nuclei, quasi tutti i primi nuclei composti formati erano nuclei di elio-4. Era così forte il legame elio-4 che la produzione di elio-4 ha consumato quasi tutti i neutroni liberi in pochi minuti, prima che potessero avere il decadimento β, e anche lasciandone molti pochi che potessero formare elementi più pesanti come il litio, il berillio e il boro. Infatti l'energia di legame per nucleone dell'elio-4 è maggior di quella di tutti questi elementi, in effetti una volta che l'elio è formato dal punto di vista energetico non è possibile formare gli elementi 3, 4 e 5. È appena possibile da un punto di vista energetico che due atomi di elio si fondano nel prossimo elemento con più piccola energia per nucleone, il carbonio. Tuttavia, questo processo, a causa della mancanza di elementi intermedi, richiede che simultaneamente tre atomi di elio collidano tra di loro (vedi processo tre alfa). Ma in realtà nei pochi minuti dopo il Big Bang non si è potuta formare una quantità significativa di carbonio, prima che la espansione dell'universo lo portasse a una temperatura e una pressione in cui la fusione dell'elio in carbonio non era più possibile. Questo ha reso l'universo primitivo con un rapporto idrogeno/elio simile all'universo come viene osservato attualmente (3 parti di idrogeno per una parte elio-4 in massa), con praticamente tutti i neutroni dell'universo intrappolati dentro l'elio-4.
Tutti gli elementi più pesanti (tra cui quelli su cui sono basati i pianeti solidi come la Terra, ma anche semplicemente il carbonio necessario alla vita) sono stati prodotti dopo il Big Bang in stelle abbastanza calde da fondere gli atomi di elio. Tutti gli elementi diversi dall'idrogeno e l'elio attualmente costituiscono solo il 2% della massa nucleare dell'universo. L'elio-4, invece, rappresenta il 23% di tutta la materia ordinaria, non considerando la materia oscura.
Disponibilità[modifica | modifica wikitesto]
Nell'universo[modifica | modifica wikitesto]
L'elio è l'elemento più diffuso dell'universo dopo l'idrogeno, forma più del 25% in massa nelle stelle e gioca un ruolo importante nelle reazioni responsabili della quantità di energia che esse producono. L'abbondanza di elio è troppo grande per essere spiegata dalle sole reazioni all'interno delle stelle, ma è coerente con il modello del Big Bang e si ritiene che la maggior parte dell'elio presente nell'universo si sia formata nei tre minuti successivi al big bang.
Sulla Terra[modifica | modifica wikitesto]
Questo elemento è presente nell'atmosfera terrestre in un rapporto di 5 ppm e si trova come prodotto del decadimento di alcuni minerali radioattivi. Specificamente, si trova nei minerali di uranio e torio, tra cui la cleveite (il primo minerale in cui fu scoperta la presenza di elio), la pechblenda, la carnotite e la monazite; è prodotto da questi elementi tramite decadimento radioattivo, nella forma di particelle alfa. Si trova inoltre in alcune acque minerali (1 parte di elio per mille d'acqua in alcune sorgenti islandesi), nei gas vulcanici e in certi depositi di gas naturali degli Stati Uniti (dai quali deriva la maggior parte dell'elio prodotto commercialmente). L'elio può essere sintetizzato bombardando atomi di litio o boro con protoni ad alta velocità.
Durante una trivellazione petrolifera nel 1903 in Kansas si ottenne un geyser gassoso composto di azoto (72%), metano (15%), idrogeno (1%) e un 12% di un gas non identificato.[11] Grazie a successive analisi Cady e McFarland scoprirono che l'1,84% di tale campione era elio.[12][13] Questo dimostrò che nonostante la sua scarsità sulla Terra l'elio era concentrato in grandi quantità sotto le Grandi Pianure statunitensi, disponibile per l'estrazione come sottoprodotto del gas naturale.[14] Questa scoperta permise agli Stati Uniti di diventare il maggior produttore al mondo di elio.
Per molti anni gli Stati Uniti hanno prodotto più del 90% dell'elio commercialmente utilizzabile al mondo; le quantità rimanenti provenivano da impianti in Canada, Polonia, Russia e altri Paesi. A metà degli anni novanta un nuovo impianto ad Arzew, in Algeria, da 17 milioni di metri cubi iniziò le operazioni con una produzione tale da soddisfare l'intera domanda europea.
Nel 2004–2006 furono costruiti altri due impianti, uno a Ras Laffan in Qatar e l'altro a Skikda in Algeria, anche se al principio del 2007 Ras Laffen funzionava al 50% e Skikda doveva ancora avviare la produzione. L'Algeria divenne rapidamente il secondo produttore di elio.[15]
In questo periodo aumentarono tanto il consumo quanto il costo di produzione dell'elio.[16]
Secondo Robert Coleman Richardson della Cornell University di Ithaca, visti gli attuali tassi di consumo dell'elio e la scarsa disponibilità di questo elemento sulla Terra, c'è il rischio che le riserve di elio finiscano entro il 2040.[17]
Composti[modifica | modifica wikitesto]
L'elio è il più inerte tra gli elementi, ma sotto l'influenza di scariche elettriche o il bombardamento di elettroni forma dei composti assieme a tungsteno, iodio, fluoro, zolfo e fosforo. Può inoltre dare luogo a eccimeri ed eccimplessi se sottoposto a eccitazione.
I composti dell'elio, particolarmente instabili, sono chiamati "eliuri".[1]
Forme[modifica | modifica wikitesto]
L'elio liquido (4He) si trova in due forme: 4He I e 4He II, che condividono un punto di transizione a 2,174 K. 4He I al di sopra di questo punto è un liquido normale, ma 4He II sotto questa temperatura è differente da qualsiasi altro fluido ordinario.
Quando viene raffreddato sotto i 2,189 K a pressione normale, il cosiddetto punto lambda, diventa un superfluido conosciuto come elio liquido II. Contrariamente al normale elio liquido I, possiede molte caratteristiche inusuali dovute a effetti quantistici; il suo comportamento fu uno dei primi esempi di effetto quantistico operante su scala macroscopica che siano stati osservati. Questa transizione avviene a una temperatura ancora più bassa nell'3He, in quanto l'effetto conta sulla condensazione dei bosoni, ma i nuclei dell'3He sono fermioni che non possono condensare individualmente ma solo in coppie bosoniche. Poiché la trasformazione è del secondo ordine superiore, senza calore latente al punto lambda, le due forme liquide non coesistono mai.
L'elio II ha viscosità molto bassa[1] e conducibilità termica molto più alta di tutte le altre sostanze (circa 800 volte maggiore di quella del rame[1]). Inoltre l'elio II mostra un effetto termomeccanico (effetto fontana): se due vasi contenenti elio II sono connessi da un capillare e uno dei due vasi viene riscaldato, si ottiene un flusso di elio verso il vaso riscaldato. Per contro, nell'effetto meccanocalorico, un flusso forzato di elio II attraverso un capillare produce il raffreddamento dell'elio II che lascia il capillare. Pulsazioni di calore introdotte nell'elio II si propagano attraverso il liquido allo stesso modo delle pulsazioni sonore, un fenomeno che è stato battezzato "secondo suono". Superfici solide a contatto con l'elio II vengono ricoperte da una pellicola di spessore da 50 a 100 atomi, questa pellicola produce uno scorrimento senza attrito del liquido; come conseguenza è impossibile contenere l'elio II in un vaso aperto senza che il liquido ne fluisca fuori. Il trasporto della massa attraverso la pellicola di elio II avviene a una quantità costante che dipende dalla temperatura. Infine una massa di elio II non ruota unitariamente, i tentativi di porla in rotazione producono piccoli vortici senza attrito attraverso il liquido.
Isotopi[modifica | modifica wikitesto]
L'elemento elio ha due soli isotopi stabili: 3He e 4He. Quest'ultimo è 'isotopo più abbondante dell'elio naturale e ne costituisce la quasi totalità (99,9998%). 4He è un nuclide composto da due protoni e due neutroni, il suo spin nucleare è 0 e pertanto è un bosone.[18] Questa configurazione è straordinariamente stabile in quanto 2 è un numero magico sia per protoni, che per neutroni, ovvero un numero per il quale essi sono disposti energeticamente a formare gusci completi;[19][20] si dice anche che è un nucleo doppiamente magico.[21][22] Ogni altra combinazione di quattro nucleoni è altamente instabile.
La grande stabilità di questo nuclide è sostanziata dalla sua energia di legame per nucleone, che ammonta 7073,916 keV,[23] un valore che raggiunge l'80,4% di quello del 62Ni,[23] il nuclide più fortemente legato.[24] Molti nuclei pesanti radioattivi decadono emettendo nuclei di 4He secondo il processo noto come decadimento alfa, e perciò i nuclei di elio vengono detti anche particelle alfa. Questi decadimenti alfa sono la principale fonte di 4He sulla Terra.
L'isotopo 3He, scoperto nel 1939, è più leggero del più comune 4He, in quanto il suo nucleo è composto da 2 protoni e un solo neutrone (3 nucleoni) contro i 2 protoni e 2 neutroni (4 nucleoni) di 4He; il suo spin nucleare è 1/2 ed è pertanto un fermione. 3He è anch'esso stabile, anche se molto meno legato (2572,680 keV)[25] di 4He. È presente in tracce sulla superficie terrestre in quanto viene prodotto dal decadimento β– del trizio (3H, emivita: 12,32 a).[26][27] Il trizio, a sua volta, viene continuamente prodotto (anche se in minime quantità) nell'alta atmosfera dall'interazione dei raggi cosmici con l'azoto atmosferico, e ricade al suolo con le precipitazioni. Una certa quota di 3He, ancora tracce, viene dalla caduta sulla Terra di polvere cosmica, che normalmente lo contiene.[28]
L'isotopo 5He (spin 3/2-), come qualsiasi altro nucleo avente A = 5, è estremamente instabile e decade coinvolgendo l'interazione nucleare forte: espelle un neutrone per dare 4He, stabile, con emivita di 7,603×10-22 s; l'energia di decadimento ammonta a 890 keV.[29]
Viene sintetizzato in laboratorio anche 6He (spin 0), che è un isotopo molto instabile, ma anche quello più longevo tra quelli radioattivi dell'elio noti finora (fino a 10He, con la possibile eccezione di 2He, del quale non si sa se sia un nucleo legato).[30] Esso decade, nella quasi totalità dei casi (≈100%), in modalità β– per dare l'isotopo stabile 6Li, con un'energia di decadimento di 3,508 MeV; nello 0,00028% dei casi il decadimento β– è accompagnato dall'espulsione di un deutone (2H), per dar luogo quindi a 4He; l'emivita è di 806,7 ms.[31]
Applicazioni[modifica | modifica wikitesto]

Benché l'ambito d'uso più noto dell'elio sia il gonfiaggio di palloncini, questo è, tuttavia, l'impiego che ne usufruisce in misura minore. L'applicazione principale è in criogenia: principalmente per raffreddare i magneti superconduttori per Imaging a risonanza magnetica (MRI) e spettrometri a NMR.
Elenchiamo dove principalmente è usato l'elio[32] (si riferisce alle previsioni negli USA nel 2014).
-
Criogenia Atmosfera controllata Saldatura Misura fuga di gas Miscele per subacquei Altro
Criogenia[modifica | modifica wikitesto]
Il suo punto di ebollizione estremamente basso rende l'elio liquido un refrigerante ideale per molte applicazioni a temperature estremamente basse quali i magneti superconduttori e le ricerche criogeniche, dove sono necessarie temperature prossime allo zero assoluto. Miscele di 3He e 4He sono usate nei refrigeratori a diluizione.
Atmosfera controllata[modifica | modifica wikitesto]
L'elio è usato come gas inerte nella crescita dei cristalli di silicio e germanio e nella produzione di titanio e zirconio. Essendo un gas ideale, inerte, con una elevata velocità del suono, e un elevato coefficiente di dilatazione adiabatica è anche usato nelle gallerie del suono supersoniche.[33]
Saldatura al tungsteno con gas inerte[modifica | modifica wikitesto]
L'elio è usato come gas di protezione nella saldatura ad arco su materiali che sono alla temperatura di saldatura o contaminati o indeboliti dall'aria o dall'azoto. Per alcuni materiali che hanno una elevata conducibilità termica come il rame e l'alluminio si preferisce usare l'elio invece del più economico argon.
Misura di fughe di gas[modifica | modifica wikitesto]

Per localizzare le perdite in impianti da vuoto viene comunemente utilizzato l'elio. L'elio diffonde attraverso i solidi tre volte più velocemente dell'aria, esso è usato come gas traccia per rivelare fughe di gas in impianti di alto vuoto. Lo strumento usato è uno spettrometro di massa a quadrupolo posto nella camera da vuoto. All'esterno viene spruzzato elio nelle varie parti e lo spettrometro di massa rivela rapidamente la presenza di elio. Anche fori che hanno una portata di solo 10−9 mbar·L/s (10−10 Pa·m3/s) possono essere trovati. Gli spettrometri di massa per l'elio sono semplici in quanto avendo l'elio una piccola massa è facilmente deviabile. Nel caso di perdite molto maggiori si pressurizza la camera da vuoto con elio e si cerca il foro con uno strumento manuale esterno. Negli impianti da vuoto l'uso di misuratori di fughe è pratica comune: spesso vengono chiamati in gergo cercafughe o più spesso con il nome inglese leak detector. La maggior parte dei materiali isolanti vetri e plastiche sono permeabili all'elio questo a volte crea confusione tra difetti reali e apparenti.
Miscele per subacquei[modifica | modifica wikitesto]
L'elio usato nella respirazione non provoca narcosi da alti fondali come l'azoto, per questa ragione miscele come il trimix, heliar o heliox sono usati per immersione a grande profondità per ridurre gli effetti della narcosi, che peggiorano con la profondità.[34][35] Un effetto indesiderato dell'elio è la modifica del tono della voce, il cosiddetto "effetto paperino", che rende difficilmente comprensibili le comunicazioni con gli operatori subacquei. Con la profondità aumenta la pressione e anche la densità del gas respirato aumenta, e l'uso dell'elio che ha un basso peso atomico riduce in maniera considerevole lo sforzo respiratorio abbassando la densità della miscela. Questo riduce il numero di Reynolds del flusso per cui si riduce il flusso turbolento e aumenta il flusso laminare di conseguenza è necessario un minore lavoro per la respirazione.[36][37] A una profondità maggiore di 120 m i sommozzatori respirando la miscela elio.ossigeno cominciano ad avere tremori e hanno una diminuzione della capacità psicomotrice, sintomi della sindrome nervosa da alta pressione.[38]
Volo[modifica | modifica wikitesto]

Poiché l'elio è più leggero dell'aria, dirigibili e palloni vengono gonfiati con elio per sollevarli. L'idrogeno sarebbe più leggero e quindi fornisce una spinta verso l'alto maggiore e inoltre ha una permeabilità inferiore attraverso le membrane, ma l'elio è non infiammabile[1] ed è un gas ritardante di fiamma. Nei razzi, l'elio è usato come mezzo di separazione e movimentazione tra il combustibile e il comburente. Viene anche usato per ripulire i serbatoi del comburente e combustibile prima del lancio e per il preraffreddamento dell'idrogeno liquido prima del lancio. Per avere un'idea, il Saturn V nel programma Apollo aveva bisogno di 370 000 m3 di elio prima del lancio.
Usi scientifici[modifica | modifica wikitesto]
- L'elio è usato come gas inerte nella gascromatografia.[1]
- L'elio è usato come gas per misure di densità assoluta, in appositi picnometri a elio che misurano il volume degli oggetti a meno della porosità raggiungibile dall'elio.
- L'uso dell'elio riduce l'effetto distorcente delle variazioni di temperatura tra le lenti in alcuni telescopi, dovuto a estremamente basso indice di rifrazione. Questo metodo è usato specialmente nei telescopi solari in cui un tubo sotto vuoto sarebbe troppo pesante.[39]
- L'età delle rocce e dei minerali che contengono uranio e torio possono essere misurate dalla quantità di elio intrappolato, è questa una tecnica recente.[40]
- Nei laboratori scientifici si fa largo uso di elio liquido per studiare le proprietà dei solidi a bassa temperatura. Il Large Hadron Collider (LHC) al CERN usa 96 tonnellate di elio per mantenere a 1,9 K i magneti superconduttori nel tunnel di 27 km che contiene l'acceleratore.[41]
Usi vari[modifica | modifica wikitesto]
- I laser a elio-neon è un piccolo tipo di laser a gas che produce un raggio rosso, è stato molto utilizzato nel passato come lettore di codice a barre e puntatore laser, prima di essere rimpiazzato quasi dappertutto dai più economici diodi laser.
- Essendo un gas inerte con elevata conducibilità termica, trasparente ai neutroni, e che non forma isotopo radioattivi all'interno dei reattori nucleari, l'elio è usato come mezzo di trasporto del calore in alcuni reattori raffreddati a gas.[1]
- L'elio mescolato con un gas inerte più pesante come lo xeno, è utilizzato per refrigerazione termoacustica in quanto ha un elevato coefficiente di dilatazione adiabatica e un piccolo numero di Prandtl.[42] L'uso di un gas inerte come l'elio ha vantaggi per l'ambiente sui sistemi di refrigerazione tradizionali che contribuiscono alla distruzione dell'ozono e causano il riscaldamento globale.[43]
- L'elio è anche usato in alcuni dischi rigidi.[44]
- Viene anche utilizzato per gonfiare palloncini in mylar o lattice per usi ludici. Data la sua scarsa densità è un ottimo (ma costoso) sostituto dell'idrogeno. A differenza dell'idrogeno presenta il vantaggio di non essere infiammabile.
- Viene utilizzato in campo medico diluito con l'aria ambientale per effettuare dei test spirometrici per verificare la capacità di riempimento dei polmoni.
- L'elio liquido trova un utilizzo crescente nell'imaging a risonanza magnetica, in quanto l'applicazione medica di questa tecnologia si sta diffondendo nell'ultimo periodo.
Fenomeni acustici[modifica | modifica wikitesto]
Dal momento che la velocità del suono è inversamente proporzionale alla radice quadrata della massa molecolare, nell'elio si ha una velocità che è circa tre volte quella nell'aria. L'altezza (o la frequenza fondamentale) di un suono prodotto da una cavità riempita da un gas è proporzionale alla velocità del suono in quel gas. Inalando dell'elio si innalza la frequenza di risonanza della laringe, rendendo la voce acuta e stridula.[45] Al contrario, inalando gas dal peso molecolare più elevato come lo xeno o l'esafluoruro di zolfo si ha l'effetto opposto.
Precauzioni[modifica | modifica wikitesto]
L'elio di per sé non è tossico per l'organismo umano, tuttavia un ambiente saturo di elio, come di altri gas, è contemporaneamente povero di ossigeno; tale condizione, indipendentemente dal fatto che il gas presente sia tossico o meno, può portare all'asfissia. Contenitori riempiti con elio gassoso a 5-10 K devono essere conservati come se contenessero elio liquido a causa dell'alto incremento di pressione che risulta dal riscaldamento del gas a temperatura ambiente. L'elio liquido ha un calore latente di evaporazione molto piccolo, per cui è praticamente impossibile ustionarsi con esso, né è facile venirne a contatto, ma oggetti che si sono portati alla temperatura dell'elio liquido e vengono estratti rapidamente possono causare ustioni.
Note[modifica | modifica wikitesto]
- ^ a b c d e f g h elio, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
- ^ Helium: Up, Up and Away? Melinda Rose, Photonics Spectra, October 2008. Accessed February 27, 2010. For a more authoritative but older 1996 pie chart showing U.S. helium use by sector, showing much the same result, see the chart reproduced in "Applications" section of this article.
- ^ Steve Connor, Why the world is running out of helium, in The Independent, London, 23 agosto 2010. URL consultato il 16 settembre 2013.
- ^ Ethan Siegel, Why the World Will Run Out of Helium, su Starts With A Bang, Scienceblogs.com, 12 dicembre 2012. URL consultato il 16 settembre 2013.
- ^ Witchalls, Clint (18 August 2010) Nobel prizewinner: We are running out of helium. New Scientist.
- ^ David Szondy, We may not be running out of helium after all, su gizmag.com. URL consultato il 1º aprile 2016.
- ^ Press release: The unbearable lightness of helium..., su EurekAlert, European Association of Geochemistry, 19 agosto 2015. URL consultato il 1º aprile 2016 (archiviato dall'url originale il 6 settembre 2015).
- ^ Ian Sample, Huge helium gas find in east Africa averts medical shortage, in The Guardian, 28 giugno 2016.
- ^ Luigi Palmieri, La riga dell'Helium apparsa in una recente sublimazione vesuviana, in Rendiconto dell'Accademia delle scienze fisiche e matematiche (Napoli), vol. 20, 1881, p. 223.«Raccolsi alcun tempo fa una sostanza amorfa di consistenza butirracea e di colore giallo sbiadato sublimata sull'orlo di una fumarola prossima alla bocca di eruzione. Saggiata questa sublimazione allo spettroscopio, ho ravvisato le righe del sodio e del potassio ed una lineare ben distinta che corrisponde esattamente alla D3 che è quella dell'Helium. Do per ora il semplice annunzio del fatto, proponendomi di ritornare sopra questo argomento, dopo di aver sottoposta la sublimazione ad una analisi chimica.»
- ^ Thayer Watkins, The Old Quantum Physics of Niels Bohr and the Spectrum of Helium: A Modified Version of the Bohr Model, su sjsu.edu, San Jose State University. URL consultato il 23 novembre 2017 (archiviato dall'url originale il 26 maggio 2009).
- ^ McFarland, D. F., Composition of Gas from a Well at Dexter, Kan, in Transactions of the Kansas Academy of Science, vol. 19, 1903, pp. 60–62, DOI:10.2307/3624173. URL consultato il 22 luglio 2008.
- ^ The Discovery of Helium in Natural Gas, su acswebcontent.acs.org, American Chemical Society, 2004. URL consultato il 20 luglio 2008 (archiviato dall'url originale il 20 maggio 2006).
- ^ Cady, H.P., McFarland, D. F., Helium in Natural Gas, in Science, vol. 24, n. 611, 1906, p. 344, DOI:10.1126/science.24.611.344, PMID 17772798.
- ^ Cady, H.P.; McFarland, D. F., Helium in Kansas Natural Gas, in Transactions of the Kansas Academy of Science, vol. 20, 1906, pp. 80–81, DOI:10.2307/3624645. URL consultato il 20 luglio 2008 (archiviato dall'url originale il 27 maggio 2012).
- ^ Smith, E.M.; Goodwin, T.W.; Schillinger, J., Challenges to the Worldwide Supply of Helium in the Next Decade (PDF), in Advances in Cryogenic Engineering, 49 A, n. 710, 2003, pp. 119–138, DOI:10.1063/1.1774674. URL consultato il 20 luglio 2008 (archiviato dall'url originale il 25 giugno 2008).
- ^ Karen H. Kaplan, Helium shortage hampers research and industry, in Physics Today, vol. 60, n. 6, American Institute of Physics, giugno 2007, pp. 31–32, DOI:10.1063/1.2754594. URL consultato il 20 luglio 2008 (archiviato dall'url originale il 4 dicembre 2008).
- ^ Allarme elio, riserve agli sgoccioli, su corriere.it, Corriere della Sera.
- ^ (EN) Nicola Manini, Introduction to the Physics of Matter, Springer, 2014, p. 38, ISBN 978-3-319-14381-1.
- ^ Shell Model of Nucleus, su hyperphysics.phy-astr.gsu.edu. URL consultato il 1º giugno 2022.
- ^ (EN) Maria G. Mayer, On Closed Shells in Nuclei, in Physical Review, vol. 74, n. 3, 1º agosto 1948, pp. 235–239, DOI:10.1103/PhysRev.74.235. URL consultato il 1º giugno 2022.
- ^ Maria Goeppert Mayer, On Closed Shells in Nuclei. II, in Physical Review, vol. 75, n. 12, 15 giugno 1949, pp. 1969–1970, DOI:10.1103/PhysRev.75.1969. URL consultato il 1º giugno 2022.
- ^ (EN) Georges Audi, The history of nuclidic masses and of their evaluation, in International Journal of Mass Spectrometry, vol. 251, n. 2, 1º aprile 2006, pp. 85–94, DOI:10.1016/j.ijms.2006.01.048. URL consultato il 1º giugno 2022.
- ^ a b Livechart - Table of Nuclides - Nuclear structure and decay data, su www-nds.iaea.org. URL consultato il 1º giugno 2022.
- ^ (EN) Richard Shurtleff e Edward Derringh, The most tightly bound nucleus, in American Journal of Physics, vol. 57, n. 6, 1989-06, pp. 552–552, DOI:10.1119/1.15970. URL consultato il 1º giugno 2022.
- ^ Livechart - Table of Nuclides - Nuclear structure and decay data, su www-nds.iaea.org. URL consultato il 1º giugno 2022.
- ^ L.L. Lucas e M.P. Unterweger, Comprehensive review and critical evaluation of the half-life of tritium (PDF), in Journal of Research of the National Institute of Standards and Technology, vol. 105, n. 4, 2000-07, pp. 541, DOI:10.6028/jres.105.043. URL consultato il 10 aprile 2022.
- ^ Aaron Novick, Half-Life of Tritium, in Physical Review, vol. 72, n. 10, 15 novembre 1947, pp. 972–972, DOI:10.1103/PhysRev.72.972.2. URL consultato il 1º giugno 2022.
- ^ Helium Fundamentals, su web.archive.org, 8 febbraio 2007. URL consultato il 1º giugno 2022 (archiviato dall'url originale l'8 febbraio 2007).
- ^ Isotope data for helium-5 in the Periodic Table, su periodictable.com. URL consultato il 28 marzo 2023.
- ^ Isotopes of Helium (PDF), su atlas.physics.arizona.edu. URL consultato il 28 marzo 2023 (archiviato dall'url originale il 22 ottobre 2022).
- ^ Isotope data for helium-6 in the Periodic Table, su periodictable.com. URL consultato il 28 marzo 2023.
- ^ U.S. Department of the Interior, U.S. Geological Survey, Helium, in Mineral Commodity Summaries 2014, 2015, pp. 72–73.
- ^ I. E. Beckwith e C. G. Miller, Aerothermodynamics and Transition in High-Speed Wind Tunnels at Nasa Langley, in Annual Review of Fluid Mechanics, vol. 22, 1990, pp. 419–439, Bibcode:1990AnRFM..22..419B, DOI:10.1146/annurev.fl.22.010190.002223.
- ^ B. Fowler, K. N. Ackles e G. Porlier, Effects of inert gas narcosis on behavior—a critical review, in Undersea Biomedical Research Journal, vol. 12, 1985, pp. 369–402, PMID 4082343. URL consultato il 23 novembre 2017 (archiviato dall'url originale il 25 dicembre 2010).
- ^ Thomas, J. R., Reversal of nitrogen narcosis in rats by helium pressure, in Undersea Biomed. Res., vol. 3, 1976, pp. 249–59, PMID 969027. URL consultato il 6 agosto 2008 (archiviato dall'url originale il 6 dicembre 2008).
- ^ S. J. Butcher, L. Richard L., J. R. Mayne, T. C. Hartley, S. R. Petersen, Impaired exercise ventilatory mechanics with the self-contained breathing apparatus are improved with heliox,European Journal of Applied Physiology, 101, pp. 659–69, (2007)
- ^ Heliox21, su bochealthcare.co.uk, Linde Gas Therapeutics, 27 gennaio 2009.
- ^ W. L., Jr. Hunger e P. B. Bennett, The causes, mechanisms and prevention of the high pressure nervous syndrome, in Undersea Biomed. Res., vol. 1, 1974, pp. 1–28, ISSN 0093-5387, OCLC 2068005, PMID 4619860. URL consultato il 23 novembre 2017 (archiviato dall'url originale il 25 dicembre 2010).
- ^ Jakobsson, H., Simulations of the dynamics of the Large Earth-based Solar Telescope, in Astronomical & Astrophysical Transactions, vol. 13, 1997, pp. 35–46, Bibcode:1997A&AT...13...35J, DOI:10.1080/10556799708208113.
- ^ http://www.geo.arizona.edu/~reiners/arhdl/longer.htm U-Th/He dating, the University of Arizona Geochronology Lab
- ^ LHC: Facts and Figures (PDF), su visits.web.cern.ch, CERN (archiviato dall'url originale il 6 luglio 2011).
- ^ Belcher, James R., Slaton, William V., Raspet, Richard, Bass, Henry E. e Lightfoot, Jay, Working gases in thermoacoustic engines, in The Journal of the Acoustical Society of America, vol. 105, 1999, pp. 2677–2684, Bibcode:1999ASAJ..105.2677B, DOI:10.1121/1.426884, PMID 10335618.
- ^ Makhijani, Arjun e Gurney, Kevin, Mending the Ozone Hole: Science, Technology, and Policy, MIT Press, 1995, ISBN 0-262-13308-3.
- ^ HGST balloons disk capacity with helium-filled 6TB drive
- ^ Andrea Frova, La scienza di tutti i giorni, BUR Biblioteca Univ. Rizzoli, 2010, p. 164, ISBN 978-88-17-04442-4.
Bibliografia[modifica | modifica wikitesto]
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni di o su elio
Wikiquote contiene citazioni di o su elio Wikizionario contiene il lemma di dizionario «elio»
Wikizionario contiene il lemma di dizionario «elio» Wikimedia Commons contiene immagini o altri file su elio
Wikimedia Commons contiene immagini o altri file su elio
Collegamenti esterni[modifica | modifica wikitesto]
- elio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- èlio, su sapere.it, De Agostini.
- (EN) helium, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 19752 · LCCN (EN) sh85060043 · GND (DE) 4132459-6 · BNF (FR) cb11978648w (data) · J9U (EN, HE) 987007555644805171 · NDL (EN, JA) 00563132 |
|---|






